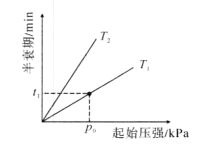
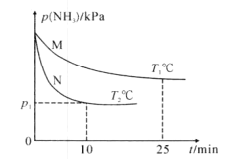
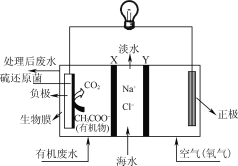
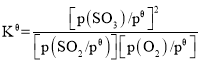题目内容
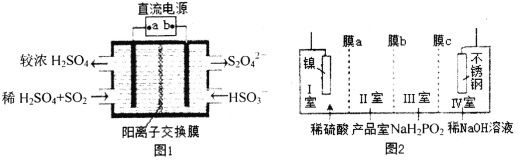
【题目】如图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法错误的
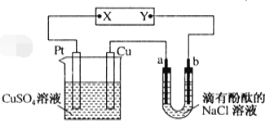
A.X极是电源正极,Y极是电源负极B.Cu电极上增重6.4g时,b极产生2.24 L气体
C.电解过程中CuSO4溶液的pH逐渐减小D.a极的电极反应式为2Cl――2e-=Cl2↑
【答案】B
【解析】
A.a、b是石墨电极,通电一段时间后,b极附近溶液显红色,依据电解质溶液为氯化钠的酚酞溶液,判断b电极是阴极生成氢气和NaOH,则Y为电源负极,X为电源正极,故A正确;
B.根据电极反应Cu-2e-=Cu2+,6.4g的铜的物质的量是0.1mol,转移电子为0.2mol,b极电极反应2H++2e-=H2↑,生成氢气为0.1mol,若为标况,则体积为2.24L,没有给温度和压强,故B错误;
C. 电解过程中CuSO4溶液中的氢氧根离子在阳极Pt电极失电子生成氧气,溶液中铜离子在Cu电极得到电子析出铜,溶液中氢离子浓度增大,溶液的pH逐渐减小,故C正确;
D.a电极是氯离子失电子发生的氧化反应,电极反应式为2Cl--2e-=Cl2↑,故D正确;
答案选B。

练习册系列答案
相关题目