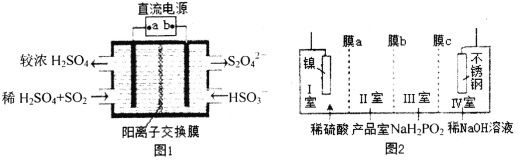
题目内容
【题目】(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
反应1:Fe2O3(s)+3C(石墨,s) ![]() 2Fe(s)+3CO(g) △H 1
2Fe(s)+3CO(g) △H 1
反应2:C(石墨,s)+CO2(g)![]() 2CO(g) △H 2
2CO(g) △H 2
①△H=__(用含△H1、△H2代数式表示)
②保持温度不变,在恒容容器中进行反应1,达到平衡状态,再次充入一定量的CO(Fe足量),则平衡__移动(填“正向”或“逆向”),达到新平衡后c(CO)将__(填“变大”、“变小”或“不变”)
(2)氯化铵常用作除锈剂,其水溶液呈酸性的原因是__。
(3)硫酸铝水解的离子方程式是__,为了抑制其水解,配制时可以加入少量的__。
(4)泡沫灭火器中装的灭火剂主要包括硫酸铝溶液、碳酸氢钠溶液。泡沫灭火器内置的玻璃筒应装__溶液,外部的铁筒装另一种溶液。
【答案】△H1-3△H2 逆向 不变 铵根离子水解使溶液呈酸性(或NH4++H2O![]() NH3·H2O+H+) Al3++3H2O
NH3·H2O+H+) Al3++3H2O![]() Al(OH)3+3H+ 稀H2SO4 硫酸铝
Al(OH)3+3H+ 稀H2SO4 硫酸铝
【解析】
(1)反应1:Fe2O3(s)+3C(石墨,s)2Fe(s)+3CO(g) △H1
反应2:C(石墨,s)+CO2(g)2CO(g) △H2
①依据盖斯定律分析计算;
②保持温度不变,在恒容容器中进行反应1,达到平衡状态,再次充入一定量的CO(Fe足量),平衡逆向进行,达到平衡状态和原来相同;
(2)氯化铵为强酸弱碱盐,铵根离子发生部分水解会使溶液显酸性;
(3)硫酸铝是强酸弱碱盐,铝离子发生部分水解会使溶液显酸性,加入对应酸会抑制盐的水解;
(4)硫酸铝中的铝离子水解得到的溶液显示酸性,能腐蚀金属铁。
反应1:Fe2O3(s)+3C(石墨,s)2Fe(s)+3CO(g) △H1
反应2:C(石墨,s)+CO2(g)2CO(g) △H2
①盖斯定律计算反应13×反应2得到Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)△H=△H13△H2,
故答案为:△H1-3△H2;
②保持温度不变,在恒容容器中进行反应1,达到平衡状态,再次充入一定量的CO(Fe足量),由于增大了生成物的浓度,所以平衡逆向进行;由于该反应中除了CO是气体外,其他物质都是固体,所以K=![]() ,温度不变,所以K不变,所以达到新平衡后c(CO)不变,
,温度不变,所以K不变,所以达到新平衡后c(CO)不变,
故答案为:逆向;不变;
(2)氯化铵为强酸弱碱盐水解显酸性,溶液中铵根离子为弱碱阳离子,结合水电离出的氢氧根离子,从而促进水的电离平衡向正向进行,使溶液中的氢离子浓度增大,其水解的离子方程式为:NH4++H2O![]() NH3·H2O+H+,
NH3·H2O+H+,
故答案为:铵根离子水解使溶液呈酸性(或NH4++H2O![]() NH3·H2O+H+);
NH3·H2O+H+);
(3)硫酸铝是强酸弱碱盐,溶液中铝离子结合水电离出的氢氧根离子促进水电离平衡正向进行,反应的离子方程式为:Al3++3H2O![]() Al(OH)3+3H+,加入对应酸抑制盐的水解,硫酸铝溶液中加入稀硫酸抑制水解,
Al(OH)3+3H+,加入对应酸抑制盐的水解,硫酸铝溶液中加入稀硫酸抑制水解,
故答案为:Al3++3H2O![]() Al(OH)3+3H+;稀H2SO4;
Al(OH)3+3H+;稀H2SO4;
(4)Al3+水解产生的H+会和金属铁反应,这样会腐蚀铁筒,所以不能把硫酸铝溶液盛在铁筒里,应放在泡沫灭火器内置的玻璃筒内,
故答案为:硫酸铝。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案