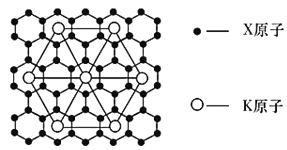
题目内容
【题目】在CF3COOH水溶液中将甲烷直接转化为CH3OH的反应机理如图,下列说法正确的是
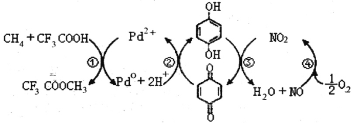
A.所含部分元素第一电离能:C<N<O<F
B.反应③的氧化剂为对苯二酚
C.此法由甲烷制取甲醇的方程式为:2CH4+O2 2CH3OH
2CH3OH
D.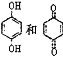 均可以与浓溴水反应,且反应类型相同
均可以与浓溴水反应,且反应类型相同
【答案】C
【解析】
A.同周期元素从左到右第一电离能呈增大趋势,第ⅤA元素原子最外层为半充满状态,第一电离能大于相连元素,则应为C<O<N<F,故A错误;
B.反应③中N元素化合价降低,被还原,氧化剂为NO2,故B错误;
C.涉及反应为CH4+CF3COOH+![]() O2→CF3COOCH3+H2O,CF3COOCH3+H2O→CF3COOH+CH3OH,则总反应为2CH4+O2
O2→CF3COOCH3+H2O,CF3COOCH3+H2O→CF3COOH+CH3OH,则总反应为2CH4+O2![]() 2CH3OH,故C正确;
2CH3OH,故C正确;
D.![]() 含有酚羟基,可与溴水发生取代反应,
含有酚羟基,可与溴水发生取代反应,![]() 含有双键,与溴水发生加成反应,故D错误。
含有双键,与溴水发生加成反应,故D错误。
故选:C。

 阅读快车系列答案
阅读快车系列答案【题目】近年来雾霾天气经常出现,研究雾霾成因和治理是当前环保的重要话题。汽车尾气和燃煤是造成空气污染的原因之一。因此研究氮氧化物的反应机理,对消除和防治环境污染有重要意义。
(1)①对于2NO(g)+2H2(g)=N2(g)+2H2O(g) △H=-665kJ/mol的反应分三步完成:
a:2NO(g)=N2O2(g)(快)
b:N2O2(g)+H2(g)=N2O(g)+H2O(g)(慢)
c:N2O(g)+H2(g)=N2(g)+H2O(g)(快)
决定此总反应速率的是第步的反应___(填序号)。
②已知:H2(g)+CO2(g)=H2O(g)+CO(g) △H=+41kJ/mol
汽车尾气的净化原理主要是用催化剂把NO与CO反应转化为两种对大气无污染的气体,试写出该反应的热化学方程式:___。
(2)升高温度能让绝大多数的化学反应加快反应速率,但是研究发现2NO(g)+O2(g)=2NO2(g) △H<0存在一些特殊现象。现有某化学小组通过实验测得不同温度下该反应速率常数k(代表反应速率的一个常数)的数值如表:
T(K) | k | T(K) | k | T(K) | k |
143 | 1.48×105 | 273 | 1.04×104 | 514 | 3.00×103 |
195 | 2.58×104 | 333 | 5.50×103 | 613 | 2.80×103 |
254 | 1.30×104 | 414 | 4.00×103 | 663 | 2.50×103 |
由实验数据测到v正与c(O2)的关系如图1所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___点(填字母),并解析原因:
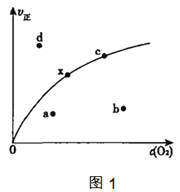
①___
②___
(3)NOx的排放主要来自于汽车尾气,包含NO2和NO,有人得出用活性炭对NOx进行吸收,发生如下反应:
反应a:C(s)+2NO(g)N2(g)+CO2(g) △H=-34.0kJ/mol
反应b:2C(s)+2NO2(g)N2(g)+2CO2(g) △H=-64.2kJ/mol
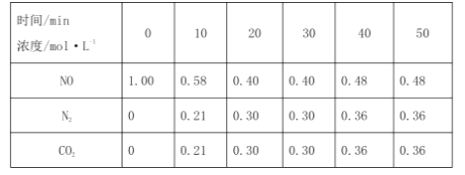
对于反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如表:
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①010min内,NO的平均反应速率v(NO)=___,当升高反应温度,该反应的平衡常数K___(选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___(填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
(4)实验室模拟反应2C(s)+2NO2(g)=N2(g)+2CO2(g) △H=-64.2kJ/mol,在密闭容器中加入一定量的碳和NO2,维持温度是T2℃,如图2为不同压强下反应b经过相同时间NO2的转化率随着压强变化的示意图。
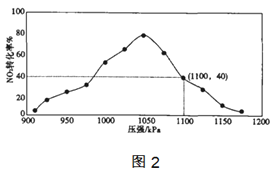
①请从动力学角度分析,1050kPa前,反应b中NO2转化率随着压强增大而增大的原因___;
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp);在T2℃、1.1×106Pa时,该反应的化学平衡常数___(用计算表达式表示,不必化简);已知:气体分压(p分)=气体总压(p总)×体积分数。