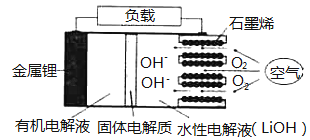
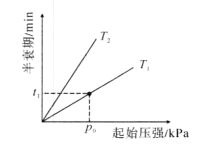
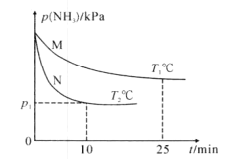
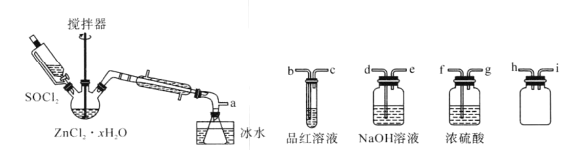
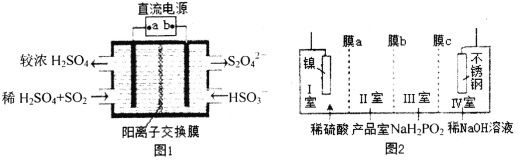
题目内容
【题目】在某温度下,可逆反应aA(g)+bB(g)![]() cC(g)+dD(g)的平衡常数为K,下列说法正确的是( )
cC(g)+dD(g)的平衡常数为K,下列说法正确的是( )
A.正、逆反应的平衡常数数值相同,符号相反
B.升高温度,K值增大
C.K越大,说明该反应的进行程度越大,转化率越高
D.该反应的K=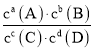
【答案】C
【解析】
A项、当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值是平衡常数,正、逆反应的平衡常数数值互为倒数,故A错误;
B项、若该反应为放热反应,升高温度,平衡向逆反应方向移动,K值减小,故B错误;
C项、平衡常数越大,说明反应进行的程度越大,转化率越高,故C正确;
D项、当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值是平衡常数,则该反应的K= ,故D错误;
,故D错误;
故选C。

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
【题目】下列根据实验现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 废FeCl3蚀刻液X中加入少量铁粉,振荡 | 得到澄清溶液 | X中一定不含Cu2+ |
B | 浓度均为0.1molL-1的Na2CO3和Na2S混合溶液中,滴入少量AgNO3溶液 | 产生黑色沉淀 | Ksp(Ag2S)大于Ksp(Ag2CO3) |
C | KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸 | 试纸变为蓝色 | NO3-还原为NH3 |
D | KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机相呈橙色 | 氧化性:Cl2>Br2 |
A.AB.BC.CD.D