题目内容
15.关于硫的叙述正确的是( )| A. | 硫的非金属性较强,所以只以化合态存在于自然界 | |
| B. | 分离黑火药(S、C、KNO3)的成分需要使用二硫化碳、水及过滤操作 | |
| C. | 硫与金属或非金属反应时均做氧化剂 | |
| D. | 1.6克硫与6.4克铜反应能得到8.0克纯净硫化物 |
分析 A、自然界中存在游离态的硫元素,但在火山喷口附近存在硫单质;
B、黑火药(S、C、KNO3)的成分分析可知,硫易溶于二硫化碳,碳不溶于水,硝酸钾溶于水,据此分析分离方法;
C、硫与非金属反应也可以做还原剂如硫和氧气的反应;
D、硫和铜反应生成硫化亚铜,结合化学方程式定量关系计算.
解答 解:A、在火山喷口附近存在硫单质,故A错误;
B、硝酸钾溶液水,而硫、碳不溶于水,应先加水溶解,过滤后,由于不溶物中硫易溶于二氧化硫,碳不能溶于二硫化碳,再将难溶物置于二硫化碳中溶解、过滤,最后留在滤纸上的是碳,故B正确;
C、硫可与氧气反应生成二氧化硫,为还原剂,硫单质和氢气反应生成硫化氢表现氧化性,故C错误;
D、1.6g硫物质的量=$\frac{1.6g}{32g/mol}$=0.05mol,6.4g铜物质的量=$\frac{6.4g}{64g/mol}$=0.1mol,发生反应2Cu+S=Cu2S,恰好反应生成氧化亚铜0.05mol,质量为0.05mol×160g/mol=8.0g,能得到8.0g纯净硫化物,故D正确.
故选BD.
点评 本题考查硫的性质,较为基础,注意相关基础知识的积累,学习中要牢固把握相关物质的性质,注意硫和变价金属生成低价化合物,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.核电荷数为1~18的元素中,最外层电子数是电子层数3倍的原子( )
| A. | 只有4种 | B. | 只有3种 | C. | 只有2种 | D. | 只有1种 |
6.下列物质,不属于合金的是( )
| A. | 硬铝 | B. | 青铜 | C. | 水银 | D. | 钢 |
3.某反应的反应过程中能量变化如图所示(如图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述不正确的是( )


| A. | 该反应为吸热反应 | |
| B. | 催化剂能降低正反应的活化能,但不能降低逆反应的活化能 | |
| C. | 催化剂能改变反应的历程 | |
| D. | 催化剂不能改变反应的焓变 |
10.有关如图所示原电池(盐桥中装有含琼脂的KCl饱和溶液)的叙述,正确的是( )


| A. | 铜是阳极,铜片上有气泡产生 | |
| B. | 铜离子在铜片表面被还原 | |
| C. | 电流从锌片经导线流向铜片 | |
| D. | 反应中,盐桥中的K+会移向ZnSO4溶液 |
20.下列检验铵盐的方法中,正确的是( )
| A. | 加入氢氧化钠溶液,加热试管,再滴入酚酞试液 | |
| B. | 加入氢氧化钠溶液,加热试管,并用湿润的红色石蕊试纸接近试管口上方 | |
| C. | 加热试管,并用湿润的红色石蕊试纸接近试管口上方 | |
| D. | 加水溶解,再用红色石蕊试纸检验其溶液 |
7.化学变化中,反应物的总能量低于生成物的总能量的是( )
| A. | 2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| B. | CaO+H2O=Ca(OH)2 | |
| C. | CaCO3 $\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ | |
| D. | CH3CH2OH(酒精)+3O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2+3 H2O |
4.下列说法或做法中正确的是( )
| A. | 氟氯烃的大量排放是造成酸雨的主要原因 | |
| B. | 等质量的同种煤粉和煤块完全燃烧,放出热量前者大于后者 | |
| C. | 液氯泄漏事故发生时,周边的人应该朝顺风方向逃逸或向避风的沟塘低洼处转移 | |
| D. | 火箭发动机有偏二甲肼(C2H8N2)与N2O4混合后充分燃烧,可生成CO2、N2和H2O |
9.高锰酸钾[KMnO4]是常用的氧化剂,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4],如图是实验室模拟制备的操作流程:
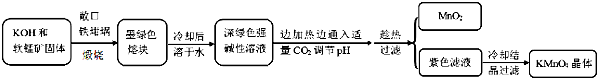
相关资料:
①物质溶解度
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀;实验中用铁坩锅煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-、2OH-+CO2═CO32-+H2O;
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中a,得到的产品纯度更高.
a.醋酸b.浓盐酸c.稀硫酸.
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图)图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀;实验中用铁坩锅煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-、2OH-+CO2═CO32-+H2O;

(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中a,得到的产品纯度更高.
a.醋酸b.浓盐酸c.稀硫酸.
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图)图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.