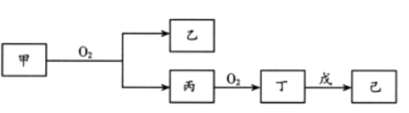
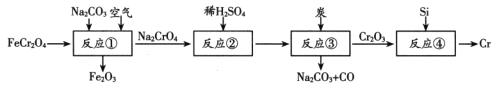
题目内容
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01molL-1的KSCN、K2CrO4溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是

A.Ksp(Ag2CrO4)的数值为10-9.92
B.a点表示的是Ag2CrO4的不饱和溶液
C.沉淀废液中的Ag+用K2CrO4溶液比等浓度的KSCN溶液效果好
D.Ag2CrO4(s)+2SCN-(aq)2AgSCN(s)+CrO42-(aq)的平衡常数为1012.08
【答案】AC
【解析】
温度不变时,溶度积为常数,Ksp(AgSCN)= c(SCN-) c(Ag+),c(Ag+)增大,则c(SCN-)减小,二者浓度变化倍数相同;Ksp(Ag2CrO4)=c(CrO42-) c2(Ag+),c(Ag+)增大,则c(CrO42-)减小,但二者浓度的变化倍数不同,结合曲线分析,当c(Ag+)由10-6mol/L增大10-2mol/L,c(Xn-)由10-6mol/L减小到10-10mol/L,由此可知二者变化倍数相同,则可以断定下面的曲线为AgSCN溶解平衡曲线,上方的曲线为Ag2CrO4溶解平衡曲线,据此分析解答。
A.根据分析,上方的曲线为Ag2CrO4溶解平衡曲线,则Ksp(Ag2CrO4)= c(CrO42-) c2(Ag+)=10-3.92×(10-4)2=10-11.92,故A错误;
B.a点的c(Ag+)小于溶解平衡时的c(Ag+),则a点的浓度积Qc(Ag2CrO4)<Ksp(Ag2CrO4),为Ag2CrO4的不饱和溶液,故B正确;
C.溶度积越小,溶液中离子浓度越小,沉淀越完全,Ksp(Ag2CrO4)= c(CrO42-) c2(Ag+)=10-3.92×(10-4)2=10-11.92,Ksp(AgSCN)= c(SCN-) c(Ag+)=10-6×10-6=10-12,Ksp(AgSCN)<Ksp(Ag2CrO4),沉淀废液中的Ag+用KSCN溶液比等浓度的K2CrO4溶液效果好,故C错误;
D.Ag2CrO4(s)+2SCN-(aq)2AgSCN(s)+CrO42-(aq)的平衡常数K= 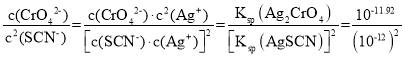 =1012.08,故D正确;
=1012.08,故D正确;
答案选AC。

【题目】1,3-丁二烯是重要的化工原料,工业上常用1-丁烯催化脱氢的方法制备。将0.lmol1-丁烯和0.675mol水蒸气组成的混合气,在80kPa恒压下进行反应:CH3CH2CH=CH2(g)![]() CH2=CHCH=CH2(g)+H2(g)△H。
CH2=CHCH=CH2(g)+H2(g)△H。
请回答下列问题:
(1)已知化学键键能数据如下,由此计算△H=____________kJmo1-1。
化学键 | C-C | C=C | C-H | H-H |
键能/kJmol-1 | 348 | 612 | 412 | 436 |
(2)如图表示脱氢反应中温度对1-丁烯的平衡转化率的影响,工业生产通常控制反应温度600℃。
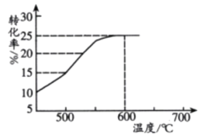
①请解释工业生产控制温度在600℃的原因___________。
②此温度下反应进行2.5h后达到平衡,从开始反应到建立平衡,以H2表示的反应速率为v(H2)=_________kPah-1;脱氢反应的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,p分=p总×物质的量分数)。
(3)在密闭容器中反应达到平衡后,再充入1.575mol1-丁烯和1.625mol1,3-丁二烯,化学反应向_________(填“正反应”、“逆反应或“不移动”)方向进行 。