题目内容
5.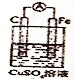 原电池实现了化学能与电能之间的转化,完成下列问题:
原电池实现了化学能与电能之间的转化,完成下列问题:(1)①如图是一个原电池装置,该电池的正极材料、电解质溶液(写化学式)正极:C,电解质溶液:CuSO4.
②写出负极上发生的电极反应式:Fe-2e-=Fe2+.
③溶液中Cu2+向正或C极移动,电子从负或Fe极流向正或C极.
(2)现有如下两个反应:(A)Na2O+2HCl═2NaCl+H2O
(B)Fe+2FeCl3═3FeCl2
①根据两反应本质,判断能否设计成原电池(填“能”或“不能”)(A)不能(B)能.
②如果(A或B)不能,说明其原因(A)的反应为非氧化还原反应,没有电子转移.
分析 (1)①铁与硫酸铜发生自发的氧化还原反应,所以正极是C,负极是铁,电解质溶液是硫酸铜;
②负极发生氧化反应,负极材料是铁,所以铁上发生的电极反应式:Fe-2e-=Fe2+;
③阳离子向正极移动,Cu2+向正极移动,电子从负极流向正极;
(2)原电池反应必须是自发进行的放热的氧化还原反应,由此分析解答.
解答 解:(1)①铁与硫酸铜发生自发的氧化还原反应,所以正极是C,负极是铁,电解质溶液是硫酸铜,故答案为:C; CuSO4;
②负极发生氧化反应,负极材料是铁,所以铁上发生的电极反应式:Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
③阳离子向正极移动,Cu2+向正极移动,电子从负极流向正极,故答案为:正或C;负或Fe,正或C;
(2)原电池反应必须是自发进行的放热的氧化还原反应,
(A)反应中没有电子转移,不属于氧化还原反应,属于复分解反应,所以不能设计成原电池,(B)反应中氯化铁中的铁元素化合价由+3价变为+2价、单质Fe元素化合价由0价变为+2价,所以该反应有电子转移,属于氧化还原反应,且能自发进行、放热,所以能设计成原电池,故答案为:①不能;能; ②(A)的反应为非氧化还原反应,没有电子转移.
点评 本题考查了原电池设计及原电池反应特点,根据电池反应式元素化合价升降确定正负极及电解质溶液,一般来说,化合价升高的金属单质作负极、化合价升高的电解质为原电池电解质,题目难度不大.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 由分子组成的物质中一定存在共价键 | |
| B. | 全部由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 只有在双原子单质分子中,相同的非金属原子之间才能形成化学键 | |
| D. | 两个非金属原子间可能形成离子键 |
17.下列对应化学反应的离子方程式书写正确的是( )
| A. | 氢氧化铁与盐酸反应:H++OH-═H2O | |
| B. | Ca(HCO3)2溶于稀盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 铁与H2SO4反应:Fe+2H+═Fe3++H2↑ | |
| D. | 澄清的石灰水与醋酸反应:OH-+CH3COOH═CH3COO-+H2O |
14.下列说法正确的是( )
| A. | H(${\;}_{1}^{1}$H),D(${\;}_{1}^{2}$H),T(${\;}_{1}^{3}$H)表示三种氢原子 | |
| B. | 原子最外层少于4个电子的元素均是金属元素 | |
| C. | 稀有气体元素最外层电子数均为8个 | |
| D. | 目前人们已发现了5000多种核素,说明发现了5000多种元素 |
15.下列有机化合物的分类不正确的是( )
| A. | 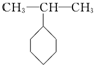 苯的同系物 | B. | 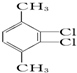 芳香化合物 | C. | 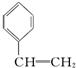 烯烃 | D. | 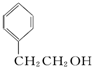 醇 |

 H2、CH3OH是优质的清洁燃料,可制作燃料电池.
H2、CH3OH是优质的清洁燃料,可制作燃料电池.