题目内容
15.将pH=8的Ba(OH)2 溶液与pH=5的稀盐酸混合,并保持100℃恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为多少?已知:100℃时,Kw=10-12.(写出计算过程)分析 先根据水的离子积常数计算氢氧化钡溶液中c(OH-),再根据盐酸和氢氧化钡之间的关系计算氢氧化钡和盐酸的体积之比.
解答 解:将pH=8的Ba(OH)2溶液中c(OH-)=10-4 mol/L,pH=5的稀盐酸中c(H+)=10-5 mol/L,
设氢氧化钡的体积为x,盐酸的体积为y,100℃的恒温,欲使混合溶液pH=7,溶液呈碱性,
c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$mol/L=10-5 mol/L,c(OH-)=$\frac{1{0}^{-4}x-1{0}^{-5}y}{x+y}$=10-5 mol/L,解得x:y=2:9,
答:Ba(OH)2与盐酸的体积比为2:9.
点评 本题考查了离子积常数的有关计算,注意混合溶液的pH=7时溶液呈碱性而不是中性,为易错点.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
5.下列反应中前者属于取代反应,后者属于加成反应的是( )
| A. | 甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯与浓硝酸和浓硫酸的混合液反应生成油状液体;乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,溴水褪色;乙烯与溴水反应 |
6.某无色气体可能含有H2S、SO2、CO2、HI、HCl、NO2气体中的一种或几种,将气体通入过量氯水后,得到无色溶液,向该溶液中滴入BaCl2溶液,有白色沉淀生成,则下列叙述正确的是( )
| A. | 该气体中肯定含有SO2 | B. | 该气体中肯定含有H2S和SO2 | ||
| C. | 该气体中肯定含有SO2和CO2 | D. | 该气体中肯定含有H2S、CO2和HI |
3.已知乙烯能被酸性高锰酸钾溶液氧化成CO2.既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯的方法是( )
| A. | 通入酸性高锰酸钾溶液中 | B. | 通入足量溴水中 | ||
| C. | 通入水中 | D. | 在空气中燃烧 |
10.某物质化学式为NH5,常温下是固态,能与水剧烈反应放出两种气体.在NH5中的各原子均具有稀有气体的稳定结构,则下列对NH5的描述中不正确的是( )
| A. | NH5属于离子晶体 | |
| B. | NH5中存在共价键 | |
| C. | NH5与水反应是非氧化还原反应 | |
| D. | NH5与NH3溶于水后所得溶液均为碱性 |
7.实验中需2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl的质量分别( )
| A. | 1000mL,117g | B. | 950mL,111.2 g | C. | 任意规格,117g | D. | 500mL,111.2g |

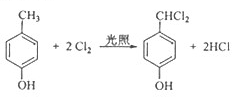 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
. .
.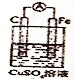 原电池实现了化学能与电能之间的转化,完成下列问题:
原电池实现了化学能与电能之间的转化,完成下列问题: