��Ŀ����
10��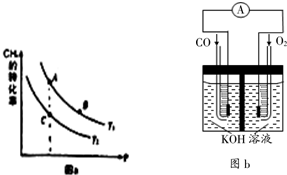 H2��CH3OH�����ʵ����ȼ�ϣ�������ȼ�ϵ�أ�
H2��CH3OH�����ʵ����ȼ�ϣ�������ȼ�ϵ�أ���1����֪����2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H1=-1275.6kJ•mol-1
��2CO��g��+O2��g���T2CO2��g����H2=-566.0kJ•mol
-1
��H2O��g���TH2O��1����H3=-44.0kJ•mol-1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ/mol��
��2�������״���ԭ��CO��H2�����з�Ӧ��CH4��g��+H2O��g��?CO��g��+3H2��g����H��0
��һ��������CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼa��ʾ����Tl��T2�������������������=������ͬ����A��B��C���㴦��Ӧƽ�ⳣ����KA��KB��KC���Ĵ�С��ϵΪKC��KB=KA
��100��ʱ����1mol��CH4��2molH2Oͨ���ݻ�Ϊ1L�Ķ����ܱ������з�����Ӧ����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����ad������ţ���
a��������ѹǿ�㶨 b����λʱ��������0.1mol��CH4ͬʱ����0.3molH2
c�������������ܶȺ㶨 d��3v����CH4��=v����H2��
����ﵽƽ��ʱCH4��ת����Ϊ0.5����100��ʱ�÷�Ӧ��ƽ�ⳣ��K=2.25��mol•L-1��2��
��3��ijʵ��С������CO��g����O2��g����KOH��aq����Ƴ���ͼb��ʾ�ĵ��װ�ã���õ�ظ����ĵ缫��ӦʽΪCO-2e-+4OH-=CO32-+2H2O��
���� ��1�����ݸ�˹���ɼ��㷴Ӧ�ȣ�д����Ӧ���Ȼ�ѧ����ʽ��
��2��������ӦΪ���ȷ�Ӧ��ѹǿһ��ʱ�������¶ȣ�ƽ��������Ӧ�����ƶ��������ת�������ݴ��ж��¶ȴ�С��
ƽ�ⳣ��ֻ���¶�Ӱ�죬���ڵ������ϸ���ƽ�ⳣ����ȣ���ͼ��֪��ѹǿһ��ʱ���¶�T2�����£������ת���ʸ�����Ӧ���еij̶ȸ���
�ڴﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�ٷֺ������䣬�Լ��ɴ���������һЩ���������䣬�ݴ˽��ѡ���жϣ�
��������ʽ����ƽ��ʱ����ֵ����ʵ���Ũ�ȣ�����ƽ�ⳣ������ʽ���㣮
��3��CO����������Ӧ���ڸ���ʧȥ���ӣ���������������̼�����ˮ��
��� �⣺��1����2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H1=-1275.6kJ/mol
��2CO ��g��+O2��g��=2CO2��g����H2=-566.0kJ/mol
��H2O��g��=H2O��l����H3=-44.0kJ/mol
�ɸ�˹���ɢ�-��+�ۡ�4���ã�2CH3OH��l��+2O2��g��=2CO ��g��+4H2O��l����H=-885.6KJ/mol��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8 kJ/mol��
��2������ͼ��ʼ��ѹǿһ��ʱ���¶�T1��ת���ʽϴ�����ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ��������ת���������¶�Tl��T2��
ƽ�ⳣ��ֻ���¶�Ӱ�죬A��B���ڵ������ϣ�ƽ�ⳣ����ȣ���ͼ��֪��ѹǿһ��ʱ���¶�T1�����£������ת���ʸ�����Ӧ���еij̶ȸ����¶�T2ʱ��ƽ�ⳣ����ƽ�ⳣ��KC��KB=KA��
�ʴ�Ϊ������KC��KB=KA��
��a���淴Ӧ���л�����������ʵ������������ݻ����䣬ѹǿ����������ѹǿ�㶨ʱ��˵������ƽ�⣬��a��ȷ��
b����λʱ��������0.1mol CH4ͬʱ����0.3molH2����Ӧʼ�հ��˱������У�����˵������ƽ�⣬��b����
c��100��ʱ����Ӧ����ﶼ�����壬����������������䣬�������ݻ����䣬�����������ܶ�ʼ�ղ��䣬����˵���õ�ƽ�⣬��c����
d��3v����CH4��=v����H2������ͬ���ʵ���������֮�ȵ��ڻ�ѧ������֮�ȣ���Ӧ����ƽ�⣬��d��ȷ��
ƽ��ʱ�����ת��Ϊ0.5��������Ũ�ȱ仯��=1mol/L��0.5=0.5mol/L��
CH4��g��+H2O��g��?CO��g��+3H2��g��
��ʼ��mol/L����1 2 0 0
�仯��mol/L����0.5 0.5 0.5 1.5
ƽ�⣨mol/L����0.5 1.5 0.5 1.5
��ƽ�ⳣ��k=$\frac{0.5��1��{5}^{3}}{0.5��1.5}$=2.25��
�ʴ�Ϊ��ad��2.25��
��3��CO����������Ӧ���ڸ���ʧȥ���ӣ���������������̼�����ˮ�������缫��ӦʽΪ��CO-2e-+4OH-=CO32-+2H2O��
�ʴ�Ϊ��CO-2e-+4OH-=CO32-+2H2O��
���� ����Ƚ��ۺϣ��Ѷ��еȣ��漰�Ȼ�ѧ����ʽ����ѧƽ��ͼ��Ӱ�����ء�ƽ�ⳣ����ƽ��״̬�жϡ�ԭ��صȣ���3���������ܷ�Ӧʽ��ȥ�����缫��Ӧʽ�ø����缫��Ӧʽ��

 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�| A�� | �Ȼ�����Һ����ˮ | B�� | NaOH��Һ����ˮ | ||
| C�� | NaHCO3��Һ����ˮ | D�� | ���������Һ����ˮ |
| A�� | �ڻ�ѧ��Ӧ��һ�������������ɣ�ͬʱ�����������ͷ� | |
| B�� | �ڻ�ѧ��Ӧ��һ�������������ɣ�����һ���������ı仯 | |
| C�� | �ڻ�ѧ��Ӧ��һ���л�ѧ���ı仯 | |
| D�� | �ڻ�ѧ��Ӧ��һ���л�ѧ���ı仯������һ���������ı仯 |
| A�� | �������O2��N2�еķ�������� | |
| B�� | ���µ�ѹ��NO��CH4�еķ�������� | |
| C�� | 20���ѹ�������O2��O3�еķ�������� | |
| D�� | ��ѹ��N2��CO2�еķ����� |
��������
| A�� | 5.25 mol/L | B�� | 12.5 mol/L | C�� | 7.5 mol/L | D�� | 6.25 mol/L |
| A�� | n��SO3����n��SO2�� | B�� | n��SO3��=1mol | C�� | 1mol��n��SO3����2mol | D�� | n��SO2��+n��SO3��=2mol |
| A�� | ����������������µĺڰ������в������ȶ����� | |
| B�� | ����ϩ����������ֱ�ͨ��������Ȼ�̼��Һ��ǰ����ɫ�����߲���ɫ | |
| C�� | ����ʹ��ˮ��ɫ����Ϊ���߷�Ӧ�������屽 | |
| D�� | Ҫ��ȥ�����е���ϩ�Ƶô��������飬�ɽ������ͨ�����Ը��������Һ�� |

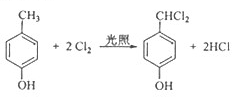 ���÷�Ӧ����Ϊȡ����Ӧ��
���÷�Ӧ����Ϊȡ����Ӧ�� ��
�� ��
��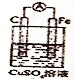 ԭ���ʵ���˻�ѧ�������֮���ת��������������⣺
ԭ���ʵ���˻�ѧ�������֮���ת��������������⣺