题目内容
【题目】已知:A、B、C、D四种元素,原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出D元素价电子的电子排布式:______________。
(2)D可形成化合物[D(H2O)6](NO3)3 。
①[D(H2O)6](NO3)3中阴离子的立体构型是_____________。NO3-中心原子的轨道杂化类型为__________。
②在[D(H2O)6] 3+中D3+与H2O之间形成的化学键称为______,1 mol [D(H2O)6] 3+ 中含有的σ键有________mol。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中________(填化学式)为非极性分子。另一种物质的电子式为_____________。
(4)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图以及晶胞的剖面图:

晶胞中距离一个A+最近的C-有________个,这些C-围成的图形是______________,若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则A+的离子半径为________cm(用含NA与ρ的式子表达)。
【答案】 3d54s1 平面三角形 sp2杂化 配位键 18 PCl5 ![]() 6 正八面体
6 正八面体 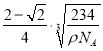
【解析】A、B、C、D四种元素,原子序数依次增大。A是短周期中原子半径最大的元素,A为Na元素;B元素3p能级半充满,B为P元素。D是第四周期未成对电子最多的元素,D为Cr元素;C是所在周期电负性最大的元素,C为第ⅦA族元素,C为Cl元素。
(1)D为Cr元素,D元素价电子的电子排布式为3d54s1,故答案为:3d54s1;
(2)①[D(H2O)6](NO3)3中NO3- NO3-中价层电子对个数=3+![]() (5+1-3×2)=3,且不含孤电子对,所以该分子为平面三角形,中心原子采用sp2杂化,故答案为:平面三角形;sp2杂化;
(5+1-3×2)=3,且不含孤电子对,所以该分子为平面三角形,中心原子采用sp2杂化,故答案为:平面三角形;sp2杂化;
②在[Cr (H2O)6] 3+配合离子中Cr3+与H2O之间形成的化学键为配位键;水分子中含有σ键2×6=12,配位键也是σ键,1 mol [D(H2O)6] 3+ 中含有的σ键有12+6=18mol,故答案为:18;
(3)已知B、C两种元素形成的化合物为PCl3和PCl5,PCl3为三角锥形结构,属于极性分子,PCl5为三角双锥结构,属于非极性分子,其中PCl3的电子式为![]() ,故答案为:PCl5;
,故答案为:PCl5; ![]() ;
;
(4)由Na、Cl两元素形成的化合物为NaCl,以中间的黑色球为Na+离子研究,与之最近的氯离子有6个,这些氯离子围成的图形是正八面体;晶胞中Na+离子数目=1+12×![]() =4,Cl-离子数目=8×
=4,Cl-离子数目=8×![]() +6×
+6×![]() =4,故晶胞质量=
=4,故晶胞质量=![]() g,晶胞体积=[
g,晶胞体积=[![]() g÷ρ]cm3=
g÷ρ]cm3=![]() cm3,令Na+离子半径为r,则棱长为
cm3,令Na+离子半径为r,则棱长为![]() ×4r=2
×4r=2![]() r,故(2
r,故(2![]() r)3=
r)3=![]() cm3,解得r=
cm3,解得r=![]() ×
×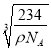 cm,故答案为:6;
cm,故答案为:6; ![]() ×
×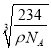 。
。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案





