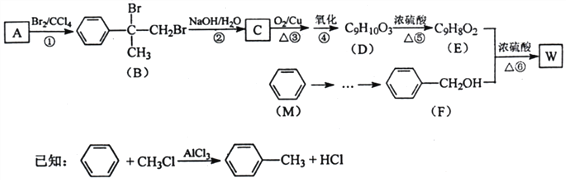
题目内容
【题目】现有A、B、C、D、E、五种短周期元素,它们的原子序数依次增大。A组成的单质是最轻的气体;B的原子最外层电子数为次外层的两倍; D为第三周期元素中原子半径最大的元素;C和D两种元素核外电子总数之和为19;E元素的最高价氧化物对应水化物的酸性最强。据此信息,回答下列问题:
(1)A位于元素周期表中第__________周期第__________族。
(2)画出C的原子结构示意图_________________。
(3)写出含有18个中子的E的一种原子符号_____________。
(4)B的原子半径____________(填“大于” 、“小于”或“等于”) C的原子半径。由B和C组成的AB2型化合物属于____________________化合物(填“离子”或“共价” ),该化合物中含有____________________________(填“离子键”、“共价键”或“离子键和共价键” )。
(5)由B、C、D三种元素组成的化合物的化学式是_________________________,其物质分类属于_____________________(填“酸” 、“碱”或“盐” )。
【答案】 一 ⅠA 略 1735Cl 大于 共价 共价键 Na2CO3 盐
【解析】本题分析:本题主要考查元素的性质。现有A、B、C、D、E、五种短周期元素,它们的原子序数依次增大。A组成的单质是最轻的气体,A是氢;B的原子最外层电子数为次外层的两倍,B是碳; D为第三周期元素中原子半径最大的元素,D是钠;C和D两种元素核外电子总数之和为19,C是氧; E元素的最高价氧化物对应水化物的酸性最强,E是氯。
(1)A位于元素周期表中第一周期第ⅠA族。
(2)C的原子结构示意图: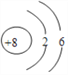 。
。
(3)原子符号左上角是质量数,左下角是质子数,含有18个中子的E的一种原子符号:1735Cl 。
(4)碳、氧处在同一周期,原子半径随原子序数增大为减小,B的原子半径大于C的原子半径。由B和C组成的AB2型化合物属于共价化合物,该化合物中含有共价键。
(5)由B、C、D三种元素组成的化合物的化学式可以是Na2CO3,其物质分类属于盐。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】在怛容条件下,反应:2SO2 ( g ) + O2 ( g ) ![]() 2SO3( g ) ;△H =-QkJ·mol-1在上述条件下分别充入的气体和反应放出的热量 ( Q>0 )如下表所列:
2SO3( g ) ;△H =-QkJ·mol-1在上述条件下分别充入的气体和反应放出的热量 ( Q>0 )如下表所列:
容 器 | SO2 (mol) | O2(mol) | N2(mol) | Q(kJ·mol-1) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是
A. 在上述条件下反应生成 lmolSO3 固体放热 Q/2 kJ B. 2Q3 <2Q2=Q1<Q
C. Ql =2 Q2= 2Q3 = Q D. 2Q2 = 2Q3 < Q1 < Q