题目内容
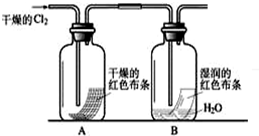
(1)某化学兴趣小组为了探究Cl2的相关性质,设计了如下的实验.①写出Cl2与水反应的离子方程式
②通入Cl2后,从集气瓶A、B的现象可得出的结论是
(2)
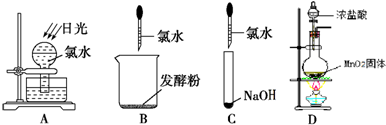
①如图所示,上述实验过程中,不会产生气体的是
②写出反应D的化学方程式
(3)碘是人体中不可缺少的微量元素,食盐中加入碘元素能有效防止缺碘引起的疾病.以前在食盐中加入碘化钾(KI),放置一年后,碘流失约92%.现在食盐中加入碘酸钾(KIO3),在相同条件下碘仅损失约7%.
①食盐中加入碘化钾的碘损失率高的原因是
②萃取碘水中的碘时,一般选用的试剂是(填字母)
A.酒精 B.四氯化碳 C.醋酸 D.硝酸银溶液
③可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾.反应的化学方程式为:5KI+KIO3+6HCl=6KCl+3I2+3H2O,反应的现象是
分析:(1)①氯气和水反应生成盐酸和次氯酸,水和次氯酸为弱电解质;
②干燥的氯气不能使干燥的有色布条褪色,干燥的氯气能使湿润的有色布条褪色;氯气有毒,不能直接排空;
(2)①A.次氯酸不稳定,光照条件下,次氯酸易分解生成盐酸和氧气;
B.发酵粉的主要成分是碳酸氢钠,碳酸氢钠和盐酸反应生成二氧化碳;
C.氢氧化钠和盐酸或次氯酸都生成可溶性的盐和水;
D.浓盐酸和二氧化锰在加热条件下能反应生成氯气;
②在加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水;
(3)①碘化钾不稳定,易被空气氧化生成碘,碘易升华;
②萃取剂和原溶剂不互溶,溶质和萃取剂不反应,且溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;
③碘单质遇淀粉试液变蓝色.
②干燥的氯气不能使干燥的有色布条褪色,干燥的氯气能使湿润的有色布条褪色;氯气有毒,不能直接排空;
(2)①A.次氯酸不稳定,光照条件下,次氯酸易分解生成盐酸和氧气;
B.发酵粉的主要成分是碳酸氢钠,碳酸氢钠和盐酸反应生成二氧化碳;
C.氢氧化钠和盐酸或次氯酸都生成可溶性的盐和水;
D.浓盐酸和二氧化锰在加热条件下能反应生成氯气;
②在加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水;
(3)①碘化钾不稳定,易被空气氧化生成碘,碘易升华;
②萃取剂和原溶剂不互溶,溶质和萃取剂不反应,且溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;
③碘单质遇淀粉试液变蓝色.
解答:解:(1)①氯气和水反应生成盐酸和次氯酸,该反应为可逆反应,离子反应方程式为:Cl2+H2O?H++Cl-+HClO,故答案为:Cl2+H2O?H++Cl-+HClO;
②干燥的氯气不能使干燥的有色布条褪色,干燥的氯气能使湿润的有色褪色,氯气溶于水得到氯水,说明氯水能使有色布条褪色,则起漂白作用的物质是氯水;
氯气有毒,不能直接排空,所以为防止氯气污染空气,最后要有尾气处理装置,
故答案为:干燥的氯气没有漂白性,氯水有漂白性;尾气吸收装置;
(2)①A.次氯酸不稳定,光照条件下,次氯酸易分解生成盐酸和氧气,所以有气体生成,故不选;
B.发酵粉的主要成分是碳酸氢钠,碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,所以有气体生成,故不选;
C.氢氧化钠和盐酸或次氯酸都生成可溶性的盐和水,所以没有气体生成,故选;
D.浓盐酸和二氧化锰在加热条件下能反应生成黄绿色气体氯气,所以有气体生成,故不选;
故选C;
②在加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(3)①碘化钾中碘离子不稳定,易被空气中氧气氧化生成碘单质,碘单质易升华导致碘化钾中碘的损失率高,故答案为:碘化钾容易在空气中被氧化成单质碘,单质碘易升华;
②A.酒精和水互溶,所以不能用酒精作萃取剂,故错误;
B.四氯化碳和水不互溶,和碘不反应,且碘在四氯化碳中的溶解度大于在水中的溶解度,所以四氯化碳能作萃取剂,故正确;
C.醋酸和水互溶,所以不能用醋酸作萃取剂,故错误;
D.硝酸银溶液和碘离子反应,且水和硝酸银溶液互溶,所以不能用硝酸银溶液作萃取剂,故错误;
故选B;
③酸性条件下,碘化钾和碘酸钾反应生成单质碘,碘遇淀粉试液变蓝色,所以反应现象为:溶液由无色变蓝色,故答案为:溶液变蓝色.
②干燥的氯气不能使干燥的有色布条褪色,干燥的氯气能使湿润的有色褪色,氯气溶于水得到氯水,说明氯水能使有色布条褪色,则起漂白作用的物质是氯水;
氯气有毒,不能直接排空,所以为防止氯气污染空气,最后要有尾气处理装置,
故答案为:干燥的氯气没有漂白性,氯水有漂白性;尾气吸收装置;
(2)①A.次氯酸不稳定,光照条件下,次氯酸易分解生成盐酸和氧气,所以有气体生成,故不选;
B.发酵粉的主要成分是碳酸氢钠,碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,所以有气体生成,故不选;
C.氢氧化钠和盐酸或次氯酸都生成可溶性的盐和水,所以没有气体生成,故选;
D.浓盐酸和二氧化锰在加热条件下能反应生成黄绿色气体氯气,所以有气体生成,故不选;
故选C;
②在加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl(浓)
| ||
| ||
(3)①碘化钾中碘离子不稳定,易被空气中氧气氧化生成碘单质,碘单质易升华导致碘化钾中碘的损失率高,故答案为:碘化钾容易在空气中被氧化成单质碘,单质碘易升华;
②A.酒精和水互溶,所以不能用酒精作萃取剂,故错误;
B.四氯化碳和水不互溶,和碘不反应,且碘在四氯化碳中的溶解度大于在水中的溶解度,所以四氯化碳能作萃取剂,故正确;
C.醋酸和水互溶,所以不能用醋酸作萃取剂,故错误;
D.硝酸银溶液和碘离子反应,且水和硝酸银溶液互溶,所以不能用硝酸银溶液作萃取剂,故错误;
故选B;
③酸性条件下,碘化钾和碘酸钾反应生成单质碘,碘遇淀粉试液变蓝色,所以反应现象为:溶液由无色变蓝色,故答案为:溶液变蓝色.
点评:本题考查较综合,涉及氯水的漂白性、萃取剂的选取、实验室制取氯气等知识点,知道起漂白作用的是次氯酸而不是氯气,注意浓盐酸和二氧化锰能反应生成氯气,但稀盐酸和二氧化锰不反应,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目