题目内容
Ⅰ.(1)某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a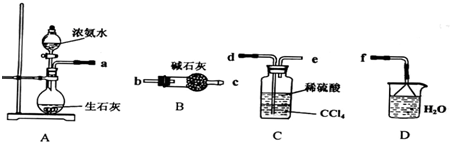
(2)将装置C中两种液体分离开的操作名称是
Ⅱ.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.工业上生产过氧化钙的主要流程如下:
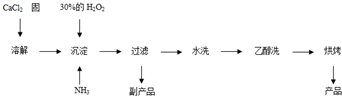
已知CaO2?8H2O呈白色,微溶于水.I2+2S2O32-=2I-+S4O62-
(1)用上述方法制取CaO2?8H2O的化学方程式是
(2)检验“水洗”是否合格的方法是
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c mol?L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.
①判断此滴定实验达到终点的方法是:
②CaO2的质量分数为
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能
分析:Ⅰ、(1)制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收;
(2)根据分离互不相溶的液体的方法分析;氨气极易溶于水,吸收时必须用防止倒吸装置;
Ⅱ、(1)根据图示流程中找出反应物、生成物,写出反应的化学方程式;
(2)通过检验洗涤液中是否含有氯离子来判断检验“水洗”是否合格;
(3)①根据滴定结束前溶液为蓝色,滴定结束是溶液由蓝色变成无色分析;
②根据电子守恒及化学反应方程式找出过氧化钙与硫代硫酸钠反应的关系式,再根据题中数据计算出样品中过氧化钙的质量分数;
③根据空气中的氧气能够氧化碘离子,使碘单质的量增加,消耗的硫代硫酸钠增加分析.
(2)根据分离互不相溶的液体的方法分析;氨气极易溶于水,吸收时必须用防止倒吸装置;
Ⅱ、(1)根据图示流程中找出反应物、生成物,写出反应的化学方程式;
(2)通过检验洗涤液中是否含有氯离子来判断检验“水洗”是否合格;
(3)①根据滴定结束前溶液为蓝色,滴定结束是溶液由蓝色变成无色分析;
②根据电子守恒及化学反应方程式找出过氧化钙与硫代硫酸钠反应的关系式,再根据题中数据计算出样品中过氧化钙的质量分数;
③根据空气中的氧气能够氧化碘离子,使碘单质的量增加,消耗的硫代硫酸钠增加分析.
解答:解:Ⅰ、(1)制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收,故连接顺序为:a→d→e→f,
故答案为:d e f;
(2)分离互不相溶的液体的方法是:分液;氨气有刺激性气味,污染空气,用水吸收多余的氨气防止污染空气,加倒置的漏斗防止倒吸,
故答案为:分液;吸收多余的NH3防止污染空气,防止倒吸;
Ⅱ、(1)由流程可知,反应物为氯化钙、双氧水、氨气和水,生成为CaO2?8H2O和氯化铵,反应的化学方程式为:CaCl2+H2O2+2NH3+8H2O=CaO2?8H2O↓+2NH4Cl,
故答案为:CaCl2+H2O2+2NH3+8H2O=CaO2?8H2O↓+2NH4Cl;
(2)检验“水洗”是否合格的方法是:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀,
故答案为:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
(3)①在滴定结束之前,溶液的淀粉与碘单质显示蓝色,当碘单质反应完全后,溶液变成无色,所以达到终点现象为:当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色,
故答案为:当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色;
②过氧化钙氧化碘化钾生成的碘单质,用硫代硫酸钠滴定时,消耗的硫代硫酸钠的物质的量为:cmol?L-1×V×10-3L=cV×10-3mol,根据氧化还原反应中电子守恒及题中反应方程式可得关系式:CaO2~I2~2S2O32-,过氧化钙的物质的量为:n(CaO2)=
n(S2O32-)=
×cV×10-3mol,
样品中CaO2的质量分数为:
×100%=
或
%,
故答案为:
或
%;
③在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高,
故答案为:偏高.
故答案为:d e f;
(2)分离互不相溶的液体的方法是:分液;氨气有刺激性气味,污染空气,用水吸收多余的氨气防止污染空气,加倒置的漏斗防止倒吸,
故答案为:分液;吸收多余的NH3防止污染空气,防止倒吸;
Ⅱ、(1)由流程可知,反应物为氯化钙、双氧水、氨气和水,生成为CaO2?8H2O和氯化铵,反应的化学方程式为:CaCl2+H2O2+2NH3+8H2O=CaO2?8H2O↓+2NH4Cl,
故答案为:CaCl2+H2O2+2NH3+8H2O=CaO2?8H2O↓+2NH4Cl;
(2)检验“水洗”是否合格的方法是:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀,
故答案为:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
(3)①在滴定结束之前,溶液的淀粉与碘单质显示蓝色,当碘单质反应完全后,溶液变成无色,所以达到终点现象为:当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色,
故答案为:当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色;
②过氧化钙氧化碘化钾生成的碘单质,用硫代硫酸钠滴定时,消耗的硫代硫酸钠的物质的量为:cmol?L-1×V×10-3L=cV×10-3mol,根据氧化还原反应中电子守恒及题中反应方程式可得关系式:CaO2~I2~2S2O32-,过氧化钙的物质的量为:n(CaO2)=
| 1 |
| 2 |
| 1 |
| 2 |
样品中CaO2的质量分数为:
| ||
| ag |
| 36cV×10-3 |
| a |
| 3.6cV |
| a |
故答案为:
| 36cV×10-3 |
| a |
| 3.6cV |
| a |
③在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高,
故答案为:偏高.
点评:本题考查了制备实验方案的设计,该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,提高学生的学科素养.该题的关键是明确物质的性质及发生的化学反应,并能灵活运用即可.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目