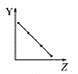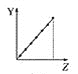题目内容
【题目】对于①NaHCO3②Na2CO3③CH3COOH④CH3COONa四种溶液物质的量浓度均为0.01mol/L,下列说法正确的是()
A.①中加入NaOH固体,![]() 增大
增大
B.②的离子浓度为:c(Na+)>c(OH-)>c(CO32-)>c(H+)
C.③溶液中加入等体积的水稀释,溶液中所有离子浓度都减小
D.②和④等体积混合:c(Na+)>c(CH3COO-)+2c(CO32-)+c(HCO3-)
【答案】D
【解析】
A.①中加入NaOH固体与碳酸氢钠反应生成碳酸钠和水,因此![]() 减小,A错误;
减小,A错误;
B.对于②Na2CO3溶液,碳酸根水解溶液显碱性,但水解程度小,因此c(OH-)<c(CO32-),B错误;
C.对于③CH3COOH,存在电离平衡:CH3COOH![]() CH3COO-+H+,当向其中加入等体积的水稀释,电离平衡正向移动,使n(H+)增大,但c(H+)减小,水的离子积常数不变,则溶液c(OH-)增大,C错误;
CH3COO-+H+,当向其中加入等体积的水稀释,电离平衡正向移动,使n(H+)增大,但c(H+)减小,水的离子积常数不变,则溶液c(OH-)增大,C错误;
D.②和④等体积混合溶液显碱性,根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)+2c(CO32-)+c(HCO3-),c(H+)<c(OH-),所以c(Na+)>c(CH3COO-)+2c(CO32-)+c(HCO3-),D正确。
答案选D。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2(g)的平衡转化率如表所示。
甲 | 乙 | 丙 | 丁 | ||
密闭容器体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
下列判断中,正确的是
A.甲中反应的平衡常数小于乙
B.SO2的平衡转化率:α1>α2=α3
C.容器中SO3的物质的量浓度:丙>甲=丁
D.该温度下,甲和乙中反应的平衡常数K均为400