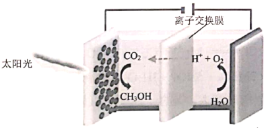
题目内容
【题目】用磁铁矿(主要成分Fe3O4、含Al2O3和SiO2等杂质),制取FeCO3的工艺流程如下:
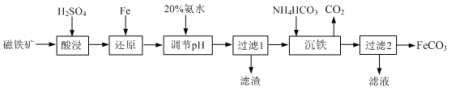
(1)“酸浸”时Fe3O4发生反应的离子反应方程式为 _______ 。
(2)“酸浸”过程中加入过量硫酸的目的是 _______ 和 _______ 。
(3)当溶液中金属离子浓度小于10-5mol·L-1时,则认为金属离子沉淀完全。若还原反应后溶液中c(Fe2+)=0.1 mol·L-1,则常温下加入20%氨水应调pH的范围为 _______ 。{已知:Ksp[Fe(OH)2]=1×10-17,Ksp[Al(OH)3]=1×10-32}
(4)“过滤1”所得滤渣除Fe、Al(OH)3外还有 _______ 。
(5)“沉铁”反应的离子方程式为: _______ 。
(6)若将“沉淀”试剂NH4HCO3改成Na2CO3,则溶液的混合方式为 _______ (填字母)。
A 向“过滤1”的滤液中滴加Na2CO3溶液,并充分搅拌
B 向Na2CO3溶液中滴加“过滤1”的滤液,并充分搅拌
C “过滤1”的滤液和Na2CO3溶液同时加入,并充分搅拌
【答案】Fe3O4+8H+=Fe2++2Fe3++4H2O 提高磁铁矿的浸取率 抑制Fe3+等金属离子水解 5~8 SiO2 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O A
【解析】
根据题给信息分析流程可知,磁铁矿加硫酸酸浸,Fe3O4、Al2O3溶解,溶液中含金属离子为 Fe2+、Fe3+和Al3+,加入Fe使Fe3+还原为 Fe2+,过滤后的溶液加入NH4HCO3生成FeCO3沉淀,过滤后的产品。
(1)Fe3O4 可表示为FeOFe2O3,含二价铁和三价铁,“酸浸”时Fe3O4发生反应的离子反应方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O。答案为:Fe3O4+8H+=Fe2++2Fe3++4H2O
(2)为提高磁铁矿的浸取率,“酸浸”过程中需加入过量的硫酸,硫酸同时还能抑制Fe3+等金属离子水解,防止因水解沉淀损失铁元素。答案为:提高磁铁矿的浸取率;抑制Fe3+等金属离子水解
(3)加入20%氨水调节pH的目的是使Al3+完全沉淀,而 Fe2+不沉淀。 Fe2+浓度为10-5mol·L-1且饱和时,Ksp[Fe(OH)2]=1×10-17=10-5mol·L-1×c2(OH-),解得c(OH-)=10-6,pH=8;Al3+浓度为10-5mol·L-1且饱和时,Ksp[Al(OH)3]=1×10-32=10-5mol·L-1×c2(OH-),解得c(OH-)=10-9,pH=5。所以应控制pH为5~8。答案为:5~8
(4)SiO2 不能被硫酸溶解,所以“过滤1”所得滤渣除Fe、Al(OH)3外还有SiO2。答案为:SiO2
(5)根据题意及流程图,“沉铁”反应产生FeCO3和CO2,离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O。答案为:Fe2++2HCO3- =FeCO3↓+CO2↑+H2O
(6)为防止溶液碱性过强生成Fe(OH)2等其它沉淀,应向“过滤1”的滤液中滴加Na2CO3溶液,使Fe2+一直处于碱性不强的环境,生成FeCO3沉淀,所以A正确,B和C方式碱性过强,不可取。答案为:A

【题目】对分别盛有不同无色溶液的①②③④四支试管进行如下操作。现象和结论对应正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向①中滴加 | 试纸变蓝 | 原溶液中有 |
B | 向②中滴入 | 有白色沉淀生成 | 原溶液中有 |
C | 向③中先滴加 | 生成白色沉淀 | 原溶液中有 |
D | 向④中滴加氯水和 | 下层溶液呈橙色 | 原溶液中有 |
A.AB.BC.CD.D