题目内容
【题目】A、B、C、D、E是原子序数依次增大的前四周期元素。已知A元素基态原子的核外电子分占四个原子轨道;B元素基态原子的成对电子数是未成对电子数的6倍;C元素是同周期元素中电负性最大的元素;D元素基态原子的L层与M层的电子数相等,且与s能级的电子总数相等;E元素可与C元素形成2种常见化合物,其中一种为棕黄色,另一种为浅绿色。
请回答下列问题:
(1)E元素基态原子的价层电子排布式为________,属于________区的元素。
(2)A、B两元素的氧化物的晶体类型分别为________、________;写出B元素的最高价氧化物与HF溶液反应的化学方程式:_____________________________。
(3)元素A的一种氢化物是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,该分子中σ键和π键的数目分别为________和________。
(4)原子总数和价电子总数都相同的分子、离子或基团属于等电子体,由A~E中的元素形成的微粒中,与SO42-互为等电子体的分子是________(填分子式,任写一种),SO42-中的键角为________。
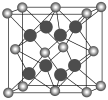
(5)D元素与最活泼的非金属元素形成的化合物的晶胞结构如图所示,其中“![]() ”代表的微粒是________(用元素符号或离子符号表示),该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________(写出表达式即可)。
”代表的微粒是________(用元素符号或离子符号表示),该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________(写出表达式即可)。
【答案】3d64s2 d 分子晶体 原子晶体 SiO2+4HF=SiF4↑+2H2O 5 1 SiCl4或CCl4 109°28′ F- ![]()
【解析】
A元素基态原子的核外电子分占四个原子轨道,则A是C元素;B元素基态原子的成对电子数是未成对电子数的6倍,则B是Si元素;C元素是同周期元素中电负性最大的元素,C是Cl元素;D元素基态原子的L层与M层的电子数相等,且与s能级的电子总数相等,则D是Ca元素;E元素可与C元素形成2种常见化合物,其中一种为棕黄色,另—种为浅绿色,则E是Fe元素,据此分析解答。
根据分析可知A为C元素,B为Si元素,C为Cl元素;D为Ca元素;E为Fe元素。
(1)E元素(Fe)基态原子的价层电子排布式为3d64s2,属于d区的元素;
(2) A、B两元素的氧化物分别是CO2是分子晶体,SiO2为原子晶体。SiO2与HF在溶液反应发生反应产生SiF4和H2O,反应的化学方程式为SiO2+4HF=SiF4↑+2H2O。
(3)元素A的一种氢化物是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,该分子是乙烯,结构简式为H2C=CH2,在乙烯分子中含有5个σ键,1个π键;
(4)由“原子总数和价电子总数都相同的分子、离子或基团属于等电子体”可知,由A~E中元素形成的微粒中,与SO42-互为等电子体的分子有SiCl4、CCl4。
SO42-的中心原子S的杂化方式为sp3杂化,SO42-为正四面体结构,则SO42-中的键角为109°28′。
(5)D是Ca元素,钙元素与最活泼的非金属元素形成的化合物为CaF2,由题给晶胞图可知,“![]() ”微粒数为8×
”微粒数为8×![]() +6×
+6×![]() =4,“
=4,“![]() ”微粒数为8,黑球与灰球的个数比为2:1,则“
”微粒数为8,黑球与灰球的个数比为2:1,则“![]() ”代表的微粒是F-。在一个晶胞中含有4个CaF2,晶胞的质量为m=
”代表的微粒是F-。在一个晶胞中含有4个CaF2,晶胞的质量为m=![]() ,晶胞的密度为a g/cm3,则晶胞的体积为V=
,晶胞的密度为a g/cm3,则晶胞的体积为V=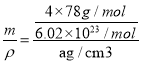 =
=![]() 。
。

 口算题天天练系列答案
口算题天天练系列答案