��Ŀ����
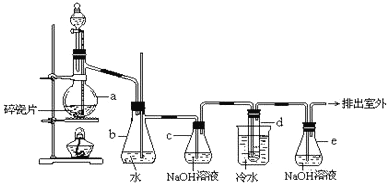
����Ŀ��ijͬѧ������ͼװ��ģ�ҵ�����Ʊ����������ᣬ������ѧ֪ʶ����������⡣
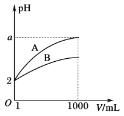
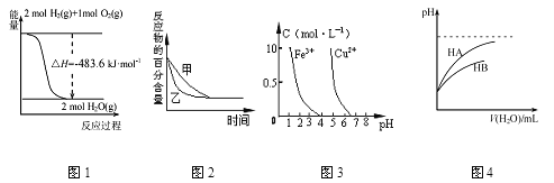
��1��ʵ��ʱ���þƾ���Ƽ��ȴ�����Ȼ��ͨ�뷴Ӧ���壬���������Ⱥ���ƾ���ƣ�����ʼ�ձ��ֺ��ȣ��¶ȿɴﵽ700�����ϡ�����ͼʾ�У��ܹ���ȷ��ʾ�÷�Ӧ���������仯����_____������ĸ����
A.
B.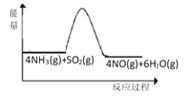
C.
��2������ʱ��2NO2��g��![]() 2NO��g��+O2��g������˰�����������Ӧ��������NO2�������������ݼ��㣬��2molNO2�ֽ�ʱ����Ӧ��_____������ա��ų�����_____kJ������
2NO��g��+O2��g������˰�����������Ӧ��������NO2�������������ݼ��㣬��2molNO2�ֽ�ʱ����Ӧ��_____������ա��ų�����_____kJ������
NO2(g)![]() N(g)+2O(g)
N(g)+2O(g)
NO(g)![]() N(g)+O(g)
N(g)+O(g)
O2(g)![]() 2O(g)
2O(g)
��3����2L���ܱվ��������У�ͨ������ʵ�����NO��O2���壬n(NO)��ʱ��ı仯���±���
t/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.012 | 0.008 | 0.005 | 0.004 | 0.004 |
�ٷ�Ӧ��ʼ����2sʱ��NO��ƽ����Ӧ����Ϊ_____��
���ڵ�5sʱ��O2��ת����Ϊ_____��
�������л������ѹǿ�뷴Ӧ��ʼʱ��ѹǿ��ֵΪ_____��
��������˵����Ӧ�Ѵ�ƽ�����_____��
a.��λʱ���ڣ�ÿ����һ�����ʵ���Ũ�ȵ�NO��ͬʱ����ͬ���ʵ���Ũ�ȵ�/span>NO2����
b.�����������ʵ������ٸı�
c.��������ƽ����Է����������ٸı�
d.�������¶Ȳ��ٷ����仯
e.�ܱ�������������ɫ���ٸı�
f.��������ܶȲ��ٸı�
���𰸡�A ���� 113 ![]() 40% 4��5 abcde
40% 4��5 abcde
��������
�Թ��з������Ĵ���������NO����װ��A��NO��һ���������������ɶ���������װ��B�ж���������ˮ��Ӧ�������ᣬ������������Һ���յ����������ֹ��Ⱦ������
��1�����������Ⱥ���ƾ���ƣ�����ʼ�ձ��ֺ��ȣ��¶ȿɴﵽ700�����ϣ�˵����ӦΪ���ȷ�Ӧ����Ӧ�������������������������ߣ���ѡA��
��2����Ӧ��=��Ӧ��ļ��ܺͣ�������ļ��ܺ�=931kJ/mol��2��628kJ/mol��2��493kJ/mol=113kJ/mol���ʵ�2molNO2�ֽ�ʱ����Ӧ������113kJ������
��3���ٷ�Ӧ��ʼ����2sʱ��NO��ƽ����Ӧ����![]() ��
��
�ڸ��ݷ�Ӧ2NO+O2![]() 2NO2���ڵ�5sʱ�����뷴Ӧ��NO�����ʵ���Ϊ0.02mol��0.004mol=0.016mol���ʲ��뷴ӦO2�����ʵ���Ϊ0.008mol����ת����
2NO2���ڵ�5sʱ�����뷴Ӧ��NO�����ʵ���Ϊ0.02mol��0.004mol=0.016mol���ʲ��뷴ӦO2�����ʵ���Ϊ0.008mol����ת����![]() ��
��
�������л������ѹǿ�ȵ������ʵ���֮�ȣ���Ӧ��ʼʱ�����������ʵ���Ϊ0.04mol����Ӧ������������ʵ���Ϊ0.004mol+0.012mol+0.016mol=0.032mol���ʷ�Ӧ��ѹǿ�뷴Ӧǰ��ѹǿ��ֵΪ0.032��0.04=4��5��
�� a.��λʱ���ڣ�ÿ����һ�����ʵ���Ũ�ȵ�NO��ͬʱ����ͬ���ʵ���Ũ�ȵ�NO2���ɣ�˵������Ӧ���ʵ����淴Ӧ���ʣ�a��ȷ��
b.��ӦΪ�����������С�ķ�Ӧ���������������ʵ������ٸı䣬����˵����Ӧ��ƽ�⣬b��ȷ��
c.��Ӧǰ���������ʵ�����С����Ӧǰ��������������䣬����������ƽ����Է����������ٸı�˵��˵����Ӧ�ﵽƽ�⣬c��ȷ��
d.��Ӧ���������ı仯�����ھ����������¶Ȳ��ٷ����仯������˵����Ӧ�ﵽƽ�⣬d��ȷ��
e.��Ӧ��ֻ�ж�������������ɫ�ģ����ܱ�������������ɫ���ٸı�ʱ��˵����������Ũ�Ȳ��䣬��Ӧ�ﵽƽ�⣬e��ȷ��
f.��Ӧǰ�������������䡢����������䣬�ʻ�������ܶ�ʼ�ղ��䣬���ܾݴ��жϷ�Ӧ�ﵽƽ�⣬f����
��ѡabcde��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�