题目内容
【题目】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,Y原子是最轻的原子,人们曾预言它可能是所有元素之母。
(1)X基态原子的电子排布式为___。
(2)C、H、O、N四种原子的电负性由大到小的顺序为___。
(3)Y负离子基态电子排布式为___。
(4)下列变化:H-(g)=H(g)+e-吸收的能量为73kJ/mol,H(g)=H+(g)+e-吸收的能量为1311kJ/mol,则氢负离子的第一电离能为__。
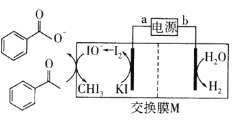
(5)水溶液中有H3O+、H5O![]() 、H9O
、H9O![]() 等微粒的形式。H3O+中,中心原子的杂化类型是__,请画出H5O
等微粒的形式。H3O+中,中心原子的杂化类型是__,请画出H5O![]() 的结构式:__。
的结构式:__。
【答案】1s22s22p63s23p63d104s1或[Ar]3d104s1 N>O>C>H 1s2 73kJ/mol sp3 
【解析】
结合构造原理写出核外电子排布式,X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,判断出X为铜元素;Y是H。元素非金属性越强,电负越强,由此判断。
(1) 由于含有7个能级,根据能量最低原则,写出7个能级为1s2s2p3s3p3d4s;且最外层电子数为1,X原子的内层轨道全部排满电子,X为铜元素,X基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2) 元素非金属性越强,电负性越强,C、N、O同周期,同周期元素从左到右非金属性逐渐增强,H 的化合价一般显正价,电负性较小,C、H、O、N四种原子的电负性由大到小的顺序为:N>O>C>H;
(3) Y是H,基态电子排布式为1s1,Y负离子是氢原子得到一个电子形成的较稳定的结构,基态电子排布式为1s2;
(4)氢负离子的第一电离能表示为氢负离子失去一个电子形成气态基态氢原子所吸收的最低能量,根据H-(g)=H(g)+e-吸收的能量为73kJ/mol,为氢负离子的第一电离能为73kJ/mol;
(5) H3O+中,氧原子分别与两个氢原子形成两对共用电子对,和一个氢原子形成一对配位键,剩余一对孤对电子,价层电子对数为4对,中心原子的杂化类型是sp3杂化,根据H5O![]() 的原子数目可知,它是一个水分子与一个水合氢离子形成一个氢键的离子,结构式:
的原子数目可知,它是一个水分子与一个水合氢离子形成一个氢键的离子,结构式: 。
。

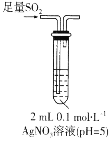
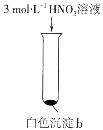
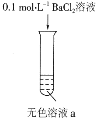
【题目】某实验小组探究SO2与AgNO3溶液的反应,实验记录如下:
序号 | Ⅰ | Ⅱ | Ⅲ |
实验 步骤 |
|
|
|
实验现象 | 得到无色溶液a和白色沉淀b | 产生无色气体,遇空气变为红棕色 | 产生白色沉淀 |
下列说法正确的是
A.透过测Ⅰ中无色溶液a的pH可以判断SO2是否被氧化
B.实验Ⅱ说明白色沉淀b具有还原性
C.实验Ⅲ说明溶液a中一定有![]() 生成
生成
D.实验Ⅰ、Ⅱ、Ⅲ说明SO2与AgNO3溶液反应既有Ag2SO4生成,又有Ag2SO3生成