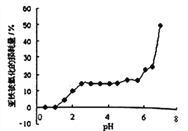
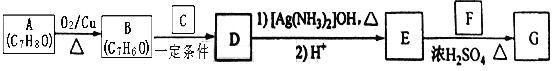
题目内容
【题目】标准状况下,1体积水中能溶解500体积的HCl气体。若向水中通入标准状况下的44.8 L HCl气体配成1 L溶液,假设气体完全溶解,所得溶液中含HCl的物质的量浓度为____________,若得溶液密度为1.0g/cm3,则溶液中含HCl质量分数为________;从该溶液中取出10 mL浓盐酸溶解于水配制成250 mL溶液,配制后的稀溶液中含HCl物质的量浓度为________。在用浓盐酸配制上述稀盐酸时,所用仪器中,使用前必须检查是否漏液的仪器有________________;配制过程中,造成浓度偏低的操作可能有________________(选填下列操作的序号)。
A.容量瓶用蒸馏水洗后未加干燥
B.量筒用蒸馏水洗后未干燥
C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯,即向容量瓶中加水到刻度
D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线
E.定容时,俯视液面加水至刻度线
【答案】2.0 mol/L7.3%0.08 mol/L250mL容量瓶(或容量瓶)BCD
【解析】
准状况下的44.8L HCl气体的物质的量=![]() =2mol,溶于水配成1L溶液,所得溶液中含HCl的物质的量浓度为:
=2mol,溶于水配成1L溶液,所得溶液中含HCl的物质的量浓度为:![]() =2mol/L;溶液的质量分数=
=2mol/L;溶液的质量分数=![]() ×100%=
×100%=![]() ×100%=7.3%;从该溶液中取出10mL浓盐酸溶解于水配置成250mL溶液,设配制后的稀溶液中含HCl物质的量浓度为C,依据溶液稀释前后所含溶质的物质的量不变得:C×250mL=2×10mL,解得C=0.08mol/L;容量瓶带有瓶塞,使用前应检验是否漏水;A.容量瓶用蒸馏水洗后未干燥,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故A不选;B.量筒用蒸馏水洗后未干燥,导致量取的氯化氢的物质的量偏小,溶液浓度偏低,故B选;C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯,即向容量瓶中加水到刻度,导致溶质的物质的量偏小,溶液浓度偏小,故C选;D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线,导致溶质的物质的量偏小,溶液浓度偏小,故D选;E.定容时,俯视液面加水至刻度线,导致溶液体积偏小,溶液浓度偏大,故E不选;故选BCD;故答案为:2mol/L;7.3%;0.08mol/L;250mL容量瓶;BCD。
×100%=7.3%;从该溶液中取出10mL浓盐酸溶解于水配置成250mL溶液,设配制后的稀溶液中含HCl物质的量浓度为C,依据溶液稀释前后所含溶质的物质的量不变得:C×250mL=2×10mL,解得C=0.08mol/L;容量瓶带有瓶塞,使用前应检验是否漏水;A.容量瓶用蒸馏水洗后未干燥,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故A不选;B.量筒用蒸馏水洗后未干燥,导致量取的氯化氢的物质的量偏小,溶液浓度偏低,故B选;C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯,即向容量瓶中加水到刻度,导致溶质的物质的量偏小,溶液浓度偏小,故C选;D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线,导致溶质的物质的量偏小,溶液浓度偏小,故D选;E.定容时,俯视液面加水至刻度线,导致溶液体积偏小,溶液浓度偏大,故E不选;故选BCD;故答案为:2mol/L;7.3%;0.08mol/L;250mL容量瓶;BCD。

【题目】某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
【答案】(1)H2SO3 (2)①2SO2+O2![]() 2SO3
2SO3
②使SO3凝结成固体与SO2分离 5SO2+2H2O+2MnO4—=5SO42—+2Mn2++4H+
③3SO2+4NaOH=Na2SO3+2NaHSO3+H2O
【解析】
(1)观察第三组可知,第二组中X物质应该属于硫呈+4价的含氧酸,即亚硫酸
(2)①SO2在V2O5的催化作用下可被氧化为SO3
②由所给数据可知SO3在冰水中呈固态,所以II装置是通过冷凝将混合气体分离
SO2可将酸性KMnO4中的锰元素还原,且有酸生成(溶液pH降低),故反应方程式为:5SO2+ 2H2O + 2MnO4-="=" 5SO42-+ 2Mn2++ 4H+
③SO2与NaOH溶液反应与两者的物质的量比有关:
SO2+ 2NaOH = Na2SO3+ H2O SO2+ NaOH =NaHSO3
现两者的物质的量比为4:7,直接由总方程式根据元素守恒来配平即可
【题型】实验题
【结束】
29
【题目】如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
![]()
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
1 | 10 mLFeO4溶液 | 10 mLNH3 | 生成白色沉淀,后变色 |
2 | 20 mLH2S | 12mLSO2 | |
3 | 30 mLNO2 | 10 mLH2O(l) | 剩有无色气体,活塞自动向内压缩 |
4 | 15 mLCl2 | 40 mLNH3 |
试回答下列问题:
(1)实验1中,沉淀最终变为_____色,写出沉淀变色的化学方程式_________________________。
(2)实验2甲针筒内的现象是:有_____________生成,活塞______移动(填向外、向内、不)。
反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(3)实验3中,甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式_______。
(4)实验4中,已知:Cl2 + NH3 → N2+ HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为____________,最后针筒中剩余气体的体积约为_________mL。