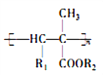
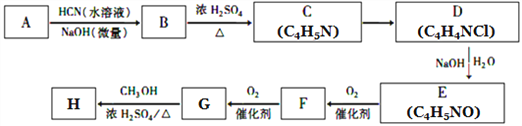
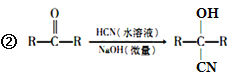
题目内容
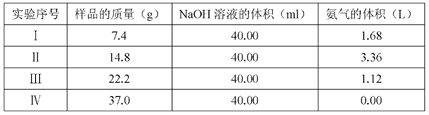
【题目】常温时,研究pH对一定浓度FeSO4的稳定性的影响,根据下图分析不合理的是:
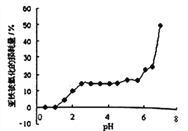
A. pH小于1时,亚铁几乎无损耗,可能的原因是4Fe2++O2+10H2O![]() 4Fe(OH)3+8H+平衡逆向移动
4Fe(OH)3+8H+平衡逆向移动
B. 其它条件相同时,FeSO4溶液中加入少量(NH4)2SO4固体,FeSO4的稳定性减弱
C. pH大于6.5时,亚铁损耗量突变,可能的原因是生成的Fe(OH)2更易被氧化
D. pH在3.0~5.5之间,pH的变化对FeSO4稳定性影响不大
【答案】B
【解析】A. 由图中信息可知,pH小于1时,亚铁几乎无损耗,说明反应4Fe2++O2+10H2O![]() 4Fe(OH)3+8H+不易发生,增大氢离子浓度能使平衡逆向移动,A正确;B. 其它条件相同时,FeSO4溶液中加入少量(NH4)2SO4固体,因铵根离子水解使溶液显酸性,故FeSO4的稳定性增强,B不正确;C. pH大于6.5时,亚铁损耗量突变,可能的原因是生成的Fe(OH)2更易被氧化,C正确;D. 由图可知,pH在3.0~5.5之间,亚铁损耗量变化不明显 ,所以pH在3.0~5.5之间时,pH的变化对FeSO4稳定性影响不大,D正确。本题选B。
4Fe(OH)3+8H+不易发生,增大氢离子浓度能使平衡逆向移动,A正确;B. 其它条件相同时,FeSO4溶液中加入少量(NH4)2SO4固体,因铵根离子水解使溶液显酸性,故FeSO4的稳定性增强,B不正确;C. pH大于6.5时,亚铁损耗量突变,可能的原因是生成的Fe(OH)2更易被氧化,C正确;D. 由图可知,pH在3.0~5.5之间,亚铁损耗量变化不明显 ,所以pH在3.0~5.5之间时,pH的变化对FeSO4稳定性影响不大,D正确。本题选B。

练习册系列答案
相关题目