题目内容
2.下列反应的离子方程式正确的是( )| A. | 向KAl(SO4)2溶液中加入Ba(OH)2至SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| B. | 偏铝酸钠溶液中加过量HCl:AlO2-+4H+=Al3++H2O | |
| C. | 向NH4HSO3溶液中滴入适量NaOH溶液:HSO3-+OH-=SO32-+H2O | |
| D. | 电镀铜时阳极反应为:Cu2++2e-=Cu |
分析 A.向KAl(SO4)2溶液中加入Ba(OH)2至SO42-完全沉淀,二者物质的量之比为1:2;
B.原子个数不守恒;
C.向NH4HSO3溶液中滴入适量NaOH溶液反应生成亚硫酸钠、一水合氨;
D.阳极发生氧化反应.
解答 解:A.向KAl(SO4)2溶液中加入Ba(OH)2至SO42-完全沉淀,反应生成硫酸钡、偏铝酸钾和水,离子方程式:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O,故A正确;
B.偏铝酸钠溶液中加过量HCl,离子方程式:AlO2-+4H+=Al3++2H2O,故B错误;
C.向NH4HSO3溶液中滴入适量NaOH溶液:NH4++HSO3-+2OH-=SO32-+H2O+NH3•H2O,故C错误;
D.电镀精炼铜时阳极反应为:Cu-2e-=Cu2+,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,题目难度不大.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | 用惰性电极电解一定浓度的硫酸铜溶液,一段时间后,加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移电子数为0.4mol | |
| B. | 磷酸的电离方程式为:H3PO4=H++H2PO4- | |
| C. | 电镀时保持电流恒定,升温可知加快反应速率 | |
| D. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 |
10.某原电池反应的离子方程式为Fe+2H+═Fe2++H2↑,则下列说法正确的是( )
| A. | 稀硝酸为电解质溶液 | B. | 锌为原电池正极 | ||
| C. | 铁极质量不变 | D. | 铜为原电池正极 |
14.下列表达反应的化学用语正确的是( )
| A. | 苯酚与纯碱溶液混合反应的离子方程式:2C6H5OH+CO32-→CO2↑+H2O+2C6H5O- | |
| B. | 溴乙烷发生水解反应的离子方程式:CH3CH2Br+OH-$→_{△}^{H_{2}O}$CH3CH2O-+H++Br- | |
| C. | 丙烯与水发生加成反应的化学方程式:CH2=CH-CH3+H2O$→_{△}^{催化剂}$CH3-O-CH2-CH3 | |
| D. | 苯酚稀溶液中加入饱和溴水: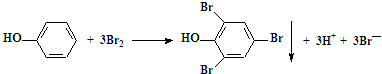 |
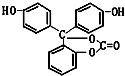 如图所示下列物质最多与5molNaOH反应,最多与4molBr2反应,最多与9molH2反应.它的分子式为C20H14O5.
如图所示下列物质最多与5molNaOH反应,最多与4molBr2反应,最多与9molH2反应.它的分子式为C20H14O5.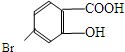 ,它的含氧官能团名称为羧基、羟基.
,它的含氧官能团名称为羧基、羟基.