题目内容
13.下列说法正确的是( )| A. | 用惰性电极电解一定浓度的硫酸铜溶液,一段时间后,加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移电子数为0.4mol | |
| B. | 磷酸的电离方程式为:H3PO4=H++H2PO4- | |
| C. | 电镀时保持电流恒定,升温可知加快反应速率 | |
| D. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 |
分析 A.惰性电极电解一定浓度的硫酸铜溶液,一段时间后,加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,说明该电解过程中相当于析出CuO和H2O,则阳极上只有氢氧根离子放电生成氧气,根据氧气和转移电子之间的关系式计算;
B.磷酸是中强酸,在水溶液中部分电离;
C.电镀时保持电流恒定,即单位时间内转移的电子数恒定,则消耗的反应物与产生的生成物的量恒定,也就是反应速率恒定;
D.如果△G=△H-T△S<0,该反应能自发进行.
解答 解:A.惰性电极电解一定浓度的硫酸铜溶液,一段时间后,加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,说明该电解过程中相当于析出CuO和H2O,则阳极上只有氢氧根离子放电生成氧气,根据O元素和转移电子之间的关系式得转移电子的物质的量=0.1mol×2×2=0.4mol,故A正确;
B.磷酸是中强酸,在水溶液中部分电离,电离方程式应该写“?”,电离方程式为H3PO4?H++H2PO4-,故B错误;
C.电镀时保持电流恒定,即单位时间内转移的电子数恒定,则消耗的反应物与产生的生成物的量恒定,也就是反应速率恒定,与温度无关,故C错误;
D.如果△G=△H-T△S<0,该反应能自发进行,该反应为熵减,则△S<0,要使△G=△H-T△S<0,则该反应的△H<0,故D错误;
故选A.
点评 本题考查原电池和电解池原理、反应自发性的判断、弱电解质的电离等知识点,侧重考查分析计算能力,易错选项是AC,注意A中阴极上不仅析出Cu还析出氢气,C中反应速率与温度无关,题目难度中等.

练习册系列答案
相关题目
8.下列有机反应的方程式书写错误的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HC1 | B. | 2CH3CH2OH+02$\stackrel{Cu、△}{→}$2CH3CH0+2H20 | ||
| C. | 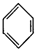 +HNO3$→_{50-60℃}^{浓硫酸}$ +HNO3$→_{50-60℃}^{浓硫酸}$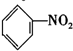 +H2O +H2O | D. | nCH2=CH2$\stackrel{一定条件}{→}$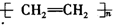 |
18.下列微粒结构示意图错误的是( )
| A. | 14C: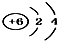 | B. | 16O: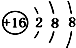 | C. | Li+: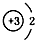 | D. | H-: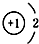 |
5.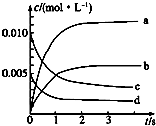 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)如图表示NO2的浓度变化的曲线是b.用O2表示从0~2s内该反应的平衡速率v=1.5×10-3mol•L-1•s-1.
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
2.下列反应的离子方程式正确的是( )
| A. | 向KAl(SO4)2溶液中加入Ba(OH)2至SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| B. | 偏铝酸钠溶液中加过量HCl:AlO2-+4H+=Al3++H2O | |
| C. | 向NH4HSO3溶液中滴入适量NaOH溶液:HSO3-+OH-=SO32-+H2O | |
| D. | 电镀铜时阳极反应为:Cu2++2e-=Cu |
3.下列说法中正确的是( )
| A. | 依据丁达尔现象可将分散系划分为溶液、胶体与浊液 | |
| B. | PM2.5(微粒直径约为2.5×10-6 m)分散在空气中形成气溶胶 | |
| C. | 光导纤维、聚乙烯、油脂都是高分子化合物 | |
| D. | 大雾的形成与汽车的尾气排放有很大关系 |
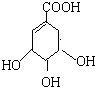 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图:
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图: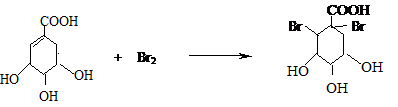 .
.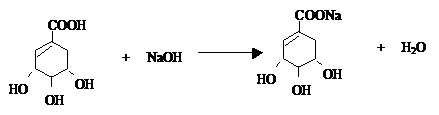 .
.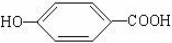 ),其反应类型消去反应.
),其反应类型消去反应.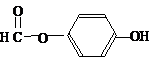 或
或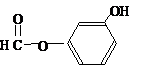 或
或 .
.