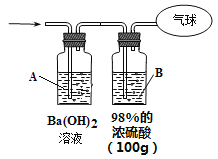
题目内容
【题目】蔗糖与浓硫酸的炭化实验会产生大量的有刺激性气味的气体,对环境产生污染。为此,某化学兴趣小组设计了如下装置进行实验。玻璃管中①②③分别为CO检测试纸(浸有氯化钯溶液的滤纸,遇CO变黑色)、滴有品红溶液的滤纸、滴有酸性KMnO4溶液的滤纸,a和b分别为两个小气球。
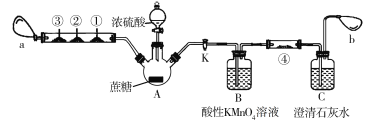
实验步骤如下:按图示连接好仪器,然后检查装置的气密性;装好试剂,夹紧止水夹K,向A瓶中的蔗糖上小心滴加浓硫酸,片刻后可观察到A瓶内蔗糖变黑,体积膨胀,有白雾产生,气球a鼓起,玻璃管中①号滤纸由白色变黑色,②号和③号滤纸均褪色。请回答以下问题:
(1)上图中盛装浓硫酸的仪器名称为________。待上述反应结束后,点燃酒精灯并在②号和③号滤纸的玻璃管附近均匀加热,观察到的现象是____________________。
(2)B瓶中酸性KMnO4溶液的作用是___________________________,发生反应的离子方程式为________________________________。
(3)打开止水夹K,使气球a内气体缓慢通过B瓶和C瓶,一段时间之后,发现澄清石灰水变浑浊,但此现象并不能证明该反应生成了CO2。为了证明有CO2生成并简化实验装置,可在④号位置放上滴有__________的滤纸(从以下试剂中选择)。
A.品红溶液 B.酸性高锰酸钾溶液 C.溴水 D.澄清石灰水
(4)若反应生成的两种碳的氧化物在相同条件下的体积比为2∶1,则蔗糖炭化后体积膨胀发生反应的化学方程式可能为_______________________________。(若是氧化还原反应,请用单线桥法在化学方程式上标明电子转移的方向和数目。)
(5)若在尾端没有气球b,会有什么不良结果?______________________________。
【答案】(1)分液漏斗 滴有品红溶液的滤纸恢复红色、滴有酸性KMnO4溶液的滤纸无变化
(2)吸收CO2中的SO2 2![]() +5SO2+2H2O2Mn2++5
+5SO2+2H2O2Mn2++5![]() +4H+
+4H+
(3)ABC
(4)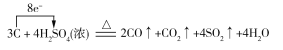 (或
(或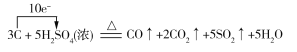 )
)
(5)使CO进入空气,污染环境
【解析】本实验为探究性实验。首先要熟悉蔗糖与浓硫酸的炭化实验,同时要认真分析题目中的若干信息,并结合中学化学中所学的氧化还原反应对所提出的问题进行解答。
(1)盛装浓硫酸的仪器是分液漏斗。因为SO2与品红作用生成不稳定的无色物质,所以加热时,滤纸②恢复红色,但SO2与酸性KMnO4溶液发生了氧化还原反应,所以加热时,滤纸③无变化。
(2)B瓶中酸性KMnO4溶液的作用是吸收CO2中的SO2,该反应的离子方程式为2![]() +5SO2+2H2O2Mn2++5
+5SO2+2H2O2Mn2++5![]() +4H+。
+4H+。
(3)在④号位置所放的滤纸是用来检测二氧化碳中的二氧化硫是否完全被B瓶吸收,以防止其对C瓶中的反应的干扰,所以A、B、C均可,若从B中导出的气体中有二氧化硫,④号位置所放的滤纸均会变色。
(4)解答此小题时,要抓住“蔗糖炭化后”及“反应生成的两种碳的氧化物在相同条件下的体积比为2∶1”进行分析,即为碳与浓硫酸的再反应,若V(CO)∶V(CO2)=2∶1,则反应的化学方程式为: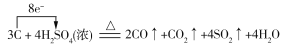 ,若V(CO2)∶V(CO)=2∶1,则反应的化学方程式为
,若V(CO2)∶V(CO)=2∶1,则反应的化学方程式为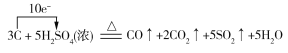 。
。
(5)若在尾端没有气球b,产生的CO直接进入空气,会污染环境。

【题目】现有三种可溶性物质A、B、C,其中A属于碱,B 、C属于盐,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | K+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)A的化学式为_____________。
(2)B溶液与C溶液反应可生成气体X,则X的化学式为_______,该反应的离子方程式为____________________________________。
(3)B、C溶液与A溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸。
①C的化学式为_____________,检验溶液C中阴离子的实验方法是____________________。
②D溶于稀硝酸的离子方程式为________________________________。
③D与E的混合物a g,加入足量盐酸,完全反应生成的气体在标准状况下体积为V L,则求算E在混合物中的质量分数的表达式为________________________________________。