题目内容
【题目】硝基苯是一种重要有机合成中间体,实验室可用如下反应合成:
C6H6+HNO3![]() C6H5—NO2+H2O ΔH<0
C6H5—NO2+H2O ΔH<0
已知:
①该反应在温度稍高的情况下会生成间二硝基苯。
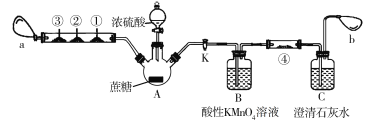
②制备反应装置:

③有关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 211 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)合成硝基苯的反应类型为_____________。
(2)制备时需要配制25 mL的浓硝酸和x mL(0.552 mol)浓硫酸(98%)混合液,混合酸应该盛放在_____________中(填写仪器名称),x值为_____________。
(3)反应在50℃~60℃下进行,其主要原因可能是__________________________(写两点即可),常用的方法是__________________________。
(4)反应完毕所得的硝基苯中混有无机物杂质,需将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液、水洗涤并分液,第二次用水洗的目的是__________________________。
(5)进行分液的硝基苯中含有少许水分及有机物杂质,加入无水aCl2颗粒,静置片刻,然后倒入蒸馏烧瓶,弃去CaCl2,最后进行蒸馏纯化,蒸馏纯化的实验方案为__________________________。从实验安全角度考虑,在蒸馏纯化过程中,应选用空气冷凝管,不选用通水的直形冷凝管的原因是__________________________________。
(6)若反应开始时向仪器A中加入19.5 mL苯,反应完毕提纯后得到20 g硝基苯,则实验所得到的硝基苯产率为_____________(精确到0.1%)。
【答案】(1)取代反应
(2)分液漏斗 30
(3)防止温度过高浓硝酸分解、减少副产物间二硝基苯生成(或温度较低,反应速率慢,温度过高反应物转化率降低) 水浴加热
(4)洗去残留的NaOH及生成的盐
(5)首先控制蒸馏温度在80℃,收集该温度下的馏分,除去苯,然后控制蒸馏温度为211℃,收集该温度下的馏分,得到纯硝基苯 以免直形冷凝管通水冷却时温差过大而发生炸裂
(6)73.9%
【解析】(1)苯环上的H原子被—NO2取代生成硝基苯,所以该反应为取代反应。
(2)混合酸应该盛放在仪器B所示的分液漏斗中,通过分液漏斗来控制加入混酸的速率。![]() ,解得x=30。
,解得x=30。
(3)根据题目信息可知,合成硝基苯的反应为放热反应,从化学反应速率和化学平衡移动观点来解释温度控制,同时浓HNO3受热易分解生成NO2、温度较高时副产物间二硝基苯也易生成。由于温度低于100℃,所以可用水浴加热方法控制温度为50~60℃ 。
(4)先用水洗除去浓H2SO4、HNO3,再用稀NaOH溶液将剩余的少量酸转化为可溶性的盐,这些盐在蒸馏时不会变为气体,便于后续分离提纯硝基苯,最后水洗除去未反应的NaOH及生成的盐。
(5)硝基苯中含有未反应的苯、副产物间二硝基苯,由于三者沸点差异较大,故采用蒸馏方法提纯,首先应该在蒸馏温度80℃下蒸馏除去苯,然后再在211℃蒸馏得到硝基苯。
(6)25 mL浓HNO3物质的量=![]() ,20 mL苯物质的量=
,20 mL苯物质的量=![]() ,根据反应方程式可知,苯不足,生成的硝基苯应为0.22 mol,理论质量=0.22 mol×123 g/mol=27.06 g,实际质量为20 g,硝基苯的产率=
,根据反应方程式可知,苯不足,生成的硝基苯应为0.22 mol,理论质量=0.22 mol×123 g/mol=27.06 g,实际质量为20 g,硝基苯的产率=![]() 。
。