题目内容
【题目】现有CO和CO2的混合气体,在标准状况下的体积为11.2L。请回答下列问题:
(1)该混合气体总的物质的量为_______。
(2)混合气体中碳原子的个数为___________。(用NA表示阿伏加德罗常数的值)
(3)为测定混合气体的组成,将该混合气体全部通过下图装置进行实验。经测定,A瓶中得到白色沉淀19.7g。
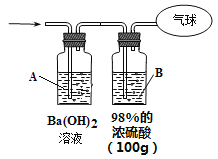
①从A瓶中获得沉淀质量的操作是_____________________称量。
②Ba(OH)2溶液浓度的测定。步骤如下:
a、过滤A溶液,得到滤液100mL(忽略溶液体积的微小变化)
b、将B瓶中的溶液配成1L溶液
c、将B瓶配制的溶液慢慢加入100mL滤液中直到不再产生沉淀。共消耗配制液50mL。
则步骤c中得到的沉淀的物质的量为______________。 原Ba(OH)2溶液的浓度为___________。
③气球中收集到的气体的质量为___________。
【答案】 0.5mol 0.5NA 过滤、洗涤、干燥 0.05mol 1.5mol/L 11.2g
【解析】(1)该混合气体总的物质的量为:n=V/Vm=11.2L÷22.4Lmol-1=0.5mol。
(2)混合气体的物质的量为0.5mol,即分子数为0.5NA,因为一个CO分子中含1个C原子,一个CO2分子中含1个C原子,所以混合气体中碳原子的个数为0.5NA。
(3)①CO和CO2的混合气体通入A瓶中,CO2与Ba(OH)2反应生成BaCO3沉淀,从A瓶中获得沉淀质量的操作是:过滤、洗涤、干燥、称量。②B瓶中H2SO4的物质的量为:100g×98%÷98gmol-1=1mol,配成1L溶液后物质的量浓度为1molL-1,与A瓶中剩余的Ba(OH)2反应消耗1molL-1的H2SO4溶液50ml,根据反应:Ba(OH)2+H2SO4=BaSO4↓+H2O可得,n(BaSO4)=n(H2SO4)=1molL-1×0.05L=0.05mol;n[Ba(OH)2]=n(H2SO4)= 0.05mol,又因为吸收CO2时产生的BaCO3是19.7g,物质的量是:19.7g÷197gmol-1=0.1mol,根据Ba元素守恒,则与CO2反应的Ba(OH)2物质的量是0.1mol,所以原Ba(OH)2溶液中溶质的物质的量为:0.05mol+0.1mol=0.15mol,则原Ba(OH)2溶液的浓度为:0.15mol÷0.1L=1.5mol/L。③CO和CO2的混合气体共0.5mol,由反应CO2+Ba(OH)2=BaCO3+H2O得,n(CO2)=n(BaCO3)=0.1mol,所以CO的物质的量为:0.5mol-0.1mol=0.4mol,质量为:0.4mol×28gmol-1=11.2g。

 名校课堂系列答案
名校课堂系列答案