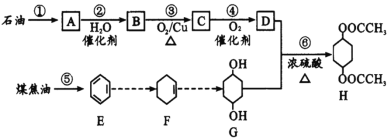
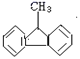
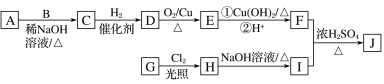
题目内容
【题目】将由Al、CuO、Fe2O3组成的混合物10.0 g放入250 mL某浓度的盐酸中,混合物完全溶解,当再加入250 mL 2.0 mol·L-1的NaOH溶液时,得到的沉淀最多。该盐酸的浓度为( )
A.0.5 mol·L-1B.3.0 mol·L-1C.2.0 mol·L-1D.1.0 mol·L-1
【答案】C
【解析】
Al、CuO、Fe2O3组成的混合物共与盐酸反应生成氯化铝、氯化铜、氯化铁,盐酸可能有剩余,向反应后溶液中加入NaOH溶液,得到的沉淀最大应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为NaCl,根据氯离子守恒有n(HCl)=n(NaCl),根据钠离子守恒有n(NaCl)=n(NaOH),再根据c=![]() 计算盐酸的浓度。
计算盐酸的浓度。
Al、CuO、Fe2O3组成的混合物共与盐酸反应生成氯化铝、氯化铜、氯化铁,盐酸可能有剩余,向反应后溶液中加入NaOH溶液,得到的沉淀最多,溶液中金属离子完全沉淀,此时溶液中溶质为NaCl,根据钠离子守恒有n(NaCl)=n(NaOH)=0.25L×2.0mol/L=0.5mol,根据氯离子守恒有n(HCl)=n(NaCl)=0.5mol,故该盐酸的物质的量浓度=![]() =2.0mol/L,故C正确;
=2.0mol/L,故C正确;

【题目】探究Mg(OH)2的溶解平衡时,利用下表三种试剂进行试验,下列说法中不正确的是( )
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1mol/L | 1mol/L |
A.向①中滴入几滴酚酞试液后,溶液显红色说明Mg(OH)2是一种弱电解质
B.为了使Mg(OH)2悬浊液溶解得更快,加入过量的NH4Cl浓溶液并充分振荡,效果更好
C.①、③混合后发生反应:![]()
D.向①中加入②,H+与OH-反应生成H2O,使c(OH-)减小,Mg(OH)2溶解平衡向溶解方向移动