题目内容
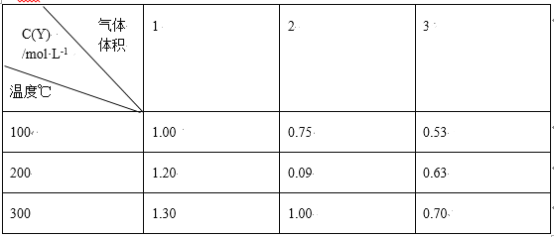
【题目】探究Mg(OH)2的溶解平衡时,利用下表三种试剂进行试验,下列说法中不正确的是( )
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1mol/L | 1mol/L |
A.向①中滴入几滴酚酞试液后,溶液显红色说明Mg(OH)2是一种弱电解质
B.为了使Mg(OH)2悬浊液溶解得更快,加入过量的NH4Cl浓溶液并充分振荡,效果更好
C.①、③混合后发生反应:![]()
D.向①中加入②,H+与OH-反应生成H2O,使c(OH-)减小,Mg(OH)2溶解平衡向溶解方向移动
【答案】A
【解析】
A. 水溶液能完全电离的电解质是强电解质,水溶液中部分电离属于弱电解质;
B. Mg(OH)2沉淀电离出来的OH-与NH4Cl电离出来的NH4+结合生成弱电解质,使c(OH-)减小,即促进Mg(OH)2的溶解;
C. NH4+能结合Mg(OH)2电离出的OH-,生成弱电解质;
D. 根据Mg(OH)2沉淀的溶解平衡移动分析。
A. 向Mg(OH)2中滴入几滴酚酞试液后,溶液显红色,只能说明Mg(OH)2能电离,使溶液呈碱性,但不能判断是部分电离还是完全电离,A项错误,符合题意;
B. Mg(OH)2沉淀电离出来的OH-与NH4Cl电离出来的NH4+结合生成NH3H2O,使Mg(OH)2悬浊液溶解的更快,可加入过量的NH4Cl浓溶液,B项正确,不符合题意;
C. NH4+结合Mg(OH)2沉淀电离出来的OH-生成NH3H2O,所以①、③混合后发生反应:![]() ,C项正确,不符合题意;
,C项正确,不符合题意;
D. Mg(OH)2的悬浊液中存在沉淀的溶解平衡,因此向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动,D项正确,不符合题意;
答案选A。

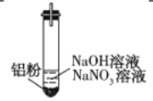
【题目】某无色溶液中可能含有H+、OH-、Na+、K+、NO![]() ,加入铝粉后,只产生H2,为探究该溶液中存在的离子,某学习小组进行了如下实验。
,加入铝粉后,只产生H2,为探究该溶液中存在的离子,某学习小组进行了如下实验。
(1)甲同学分析“若H+大量存在,则NO![]() 就不能大量存在”,设计实验证实如下:
就不能大量存在”,设计实验证实如下:
装置 | 现象 |
| Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,液面上方出现浅棕色气体 Ⅲ.试管变热,溶液沸腾 |
①现象Ⅲ产生的原因___。
②根据现象Ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
实验 | 内容 | 现象 |
实验1 | 将湿润KI—淀粉试纸置于空气中 | 试纸未变蓝 |
实验2 | 用湿润KI—淀粉试纸检验浅棕色气体 | 试纸变蓝 |
实验1、2说明反应生成了NO。
请用化学方程式解释气体变为浅棕色的原因___。
(2)乙同学分析“若OH-大量存在,NO![]() 也可能不大量存在”,重新设计实验证实如下:
也可能不大量存在”,重新设计实验证实如下:
装置 | 现象 |
| Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,有刺激性气味 |
为确认:"刺激性气味”气体,进行如下实验:用湿润KI—淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝。
产生该刺激性气味气体的离子方程式是___。
(3)甲、乙两位同学设计的实验初始时均未见明显现象的原因是___。
(4)根据以上实验分析,该溶液中一定大量存在的离子是___。