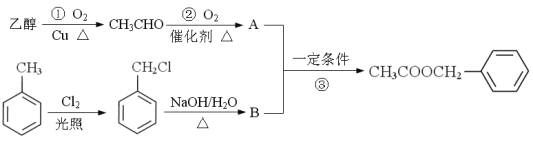
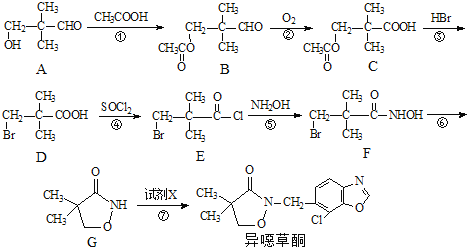
��Ŀ����
����Ŀ��������������ѧ������С�������ϳɳ�114��Ԫ�أ�Fl����һ��ͬλ�أ���ԭ�ӵ���������289���Իش��������⣺
��1����Ԫ�������ڱ���λ�ڵ�___________���ڣ�___________�壬���ڽ���Ԫ�ػ��Ƿǽ���Ԫ��? ___________��
��2����ԭ�Ӻ���������Ϊ___________��
��3�������Ԫ�ش�������������Ӧ��ˮ�����д���仯ѧʽ___________��
�������±�ΪԪ�����ڱ��IJ��֣��г���10��Ԫ����Ԫ�����ڱ��е�λ�ã��Իش��������⣺
��1���ڢۢ�����Ԫ������������ˮ���������ǿ������˳����___________���ѧʽ����
��2��10��Ԫ���У�ԭ�Ӱ뾶��С����___________������ţ���
��3��Ԫ�������⻯�������ĵ��ʷ�Ӧ�����ӷ���ʽΪ___________��
��4��Ԫ��������������������ˮ�������Ӧ�Ļ�ѧ����ʽΪ___________��
��5��Ԫ������ԭ������Ϊ___________���䵥���������⻯������·�Ӧ�Ļ�ѧ����ʽΪ___________��
��6���������������������γɵĻ������У�������Һ��ɫΪ___________ɫ��
�������ж�����������ȷ����___________
���ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ�
Ԫ�ش��� | L | M | Q | R | T |
ԭ�Ӱ뾶/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
��Ҫ���ϼ� | +2 | +3 | +2 | +6��-2 | -2 |
A��L2+��R2-�����������
B��������ϡ���ᷴӦ������L��Q
C��M��T�γɵĻ�����һ����������
D���⻯��ķе�ΪHnT��HnR
E.T��R�γɵ�TR2��TR3��Ϊ���ۻ�����
F. Q��M�ĵ��ʾ��������ᡢNaOH��Һ��Ӧ�ų�����
���𰸡���������1��7����A��������
��2��175��
��3��H4FlO4��
������ ��1��KOH��NaOH��Mg��OH��2��
��2������
��3��Cl2+H2O=H++Cl-+HClO��
��4��NaOH+Al��OH��3=NaAlO2+2H2O��
��5��26��3Fe+4H2O��g��![]() Fe3O4+4H2��
Fe3O4+4H2��
��6���ϡ�
������CDF��
�������������������������1����7���ڵ���A�壬���ڽ���Ԫ�أ��ʴ�Ϊ�� 7����A��������
��2����ԭ�Ӻ���������Ϊ289-114=175���ʴ�Ϊ��175��
��3����Ԫ�ص����Ϊ+4�ۣ�����������Ӧ��ˮ����ΪH4FlO4���ʴ�Ϊ��H4FlO4��
��������Ԫ�������ڱ��е�λ�ÿ�֪����ΪH����ΪNa����ΪK����ΪMg����ΪAl����ΪC����ΪO����ΪCl����ΪI����ΪFe��
��1��������ԽǿK��Na��Mg������������ˮ������ԣ�KOH��NaOH��Mg��OH��2���ʴ�Ϊ��KOH��NaOH��Mg��OH��2��
��2��Hԭ��ֻ��1�����Ӳ㣬��ԭ�Ӱ뾶��С���ʴ�Ϊ������
��3����ΪOԪ�أ����⻯��ΪH2O�����ĵ���ΪCl2��������ˮ��Ӧ��������ʹ����ᣬ�����������ᣬ��Ӧ�����ӷ���ʽ��Cl2+H2O=H++Cl-+HClO���ʴ�Ϊ�� Cl2+H2O=H++Cl-+HClO��
��4����������������������Ӧ����ƫ��������ˮ����Ӧ����ʽΪ��NaOH+Al��OH��3=NaAlO2+2H2O���ʴ�Ϊ��NaOH+Al��OH��3=NaAlO2+2H2O��
��5��Ԫ����ΪFe��λ�����ڱ��е������������壬��ԭ������Ϊ26����ΪOԪ�أ����⻯��ΪH2O������ˮ���������·�Ӧ������������������������Ӧ�Ļ�ѧ����ʽΪ��3Fe+4H2O��g��![]() Fe3O4+4H2���ʴ�Ϊ��26��3Fe+4H2O��g��
Fe3O4+4H2���ʴ�Ϊ��26��3Fe+4H2O��g��![]() Fe3O4+4H2��
Fe3O4+4H2��
��6���������γɻ�����Ļ�ѧʽΪCCl4���ⵥ���������Ȼ�̼����Һ����ɫ���ʴ�Ϊ���ϡ�
������������Ԫ�أ�R��T����-2�ۣ�������A�壬R��+6�ۣ�Tֻ��-2�ۣ���TΪOԪ�ء�RΪSԪ�أ�L��Q����+2�ۣ�������A�壬ԭ�Ӱ뾶L��Q����LΪMgԪ�ء�QΪBeԪ�أ�M��+3�ۣ�������A�壬ԭ�Ӱ뾶M�Ľ���Mg��S֮�䣬��MΪAlԪ�أ�A��L2+�ĺ��������Ϊ12-2=10��R2-�ĺ��������Ϊ16-��-2��=18������ȣ���A����B��������Mg��Be����Mg���ᷴӦ�����ң���B����C��M��T�γɵĻ������������������������������C��ȷ��D��ˮ����֮�����������⻯��ķе�ΪH2O��H2S����D��ȷ��E.T��R�����γɵ�OS2��OS3�������E����F. Be��Al���ڶԽ���λ�ã����ʾ��������ԣ����ʾ��������ᡢNaOH��Һ��Ӧ�ų���������F��ȷ����ѡCDF��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���Թ�����Ϊ�����������������V2O5���ǽӴ�����������Ĵ������ӷϷ������л���V2O5�ȱ�����Ⱦ��������������Դ�ۺ����á��Ϸ���������Ҫ�ɷ�Ϊ��
���� | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
��������/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
������һ�ַϷ��������չ���·�ߣ�
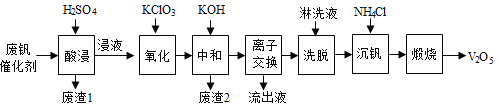
�ش��������⣺
��1���������ʱV2O5ת��ΪVO2+����Ӧ�����ӷ���ʽΪ________________________��ͬʱV2O4ת��VO2+��������1������Ҫ�ɷ���__________________��
��2��������������ʹ3 mol��VO2+��ΪVO2+������Ҫ������KClO3����Ϊ_____________mol��
��3�����к�������֮һ��ʹ����V4O124��ʽ��������Һ�С�������2���к���______________��
��4�������ӽ���������ϴ�����ɼ�ʾΪ��4ROH+ V4O124![]() R4V4O12+4OH��ROHΪǿ���������ӽ�����֬����Ϊ�����ϴ��Ч�ʣ���ϴҺӦ�ó�_____�ԣ�����������������������������
R4V4O12+4OH��ROHΪǿ���������ӽ�����֬����Ϊ�����ϴ��Ч�ʣ���ϴҺӦ�ó�_____�ԣ�����������������������������
��5�����������õ�ƫ����泥�NH4VO3��������д�����������з�����Ӧ�Ļ�ѧ����ʽ____________��