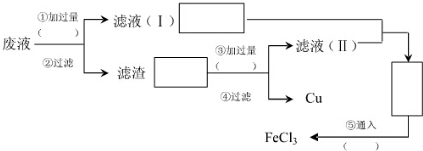
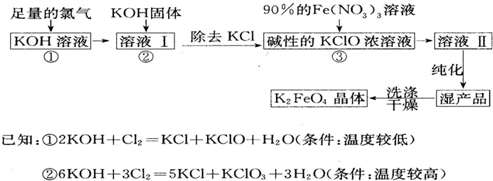
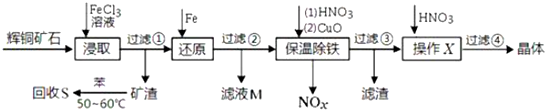
题目内容
10.已知2Al+2NaOH+2H2O→2NaAlO2+3H2↑.对于该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )| A. | 每生成0.6mol H2,被还原的水分子数目为1.2NA | |
| B. | 有2.7g Al参加反应时,转移的电子数目为0.3NA | |
| C. | 有6.72L H2生成时,反应中转移的电子数目为0.6NA | |
| D. | 溶液中每增加0.1mol AlO${\;}_{2}^{-}$,Na+的数目就增加0.1NA |
分析 A.反应过程为:2Al+6H2O═2Al(OH)3+3H2↑,Al(OH)3+2NaOH═NaAlO2+2H2O,结合方程式计算被还原水;
B.根据n=$\frac{m}{M}$计算Al的物质的量,结合Al元素化合价变化计算转移电子;
C.氢气不一定处于标况下,6.72L H2不一定为0.3mol;
D.反应生成NaAlO2,溶液中AlO2-水解,溶液中Na+的物质的量大于AlO2-物质的量.
解答 解:A.反应过程为:2Al+6H2O═2Al(OH)3+3H2↑,Al(OH)3+2NaOH═NaAlO2+2H2O,由2Al+6H2O═2Al(OH)3+3H2↑,可知每生成0.6mol H2,被还原的水为0.6mol×$\frac{6}{3}$=1.2mol,故被还原的水分子数目为1.2NA,故A正确;
B.2.7Al的物质的量为$\frac{2.7g}{27g/mol}$=0.1mol,转移的电子为0.1mol×(3-0)=0.3mol,所以转移电子数目为0.3NA,故B正确;
C.氢气不一定处于标况下,6.72L H2不一定为0.3mol,故C错误;
D.反应生成NaAlO2,溶液中AlO2-水解,溶液Na+的物质的量大于AlO2-物质的量,溶液中每增加0.1mol AlO2-,则Na+的数目就增加大于0.1NA,故D错误,
故选:AB.
点评 本题考查较综合,涉及氧化还原反应、物质的量的计算及盐类水解等知识,选项C为易错点,学生容易忽略所处状态,注意水为该反应中的氧化剂,题目难度中等.

练习册系列答案
相关题目
13.下列各物质所属晶体类型与所给信息相符合的是( )
| 编号 | 信 息 | 晶体类型 |
| A | 沸点低,易溶于水,水溶液能导电 | 离子晶体 |
| B | 熔点630.74℃,沸点1750℃,液态能导电 | 分子晶体 |
| C | 熔点3410℃,硬度大,固体不能导电 | 金属晶体 |
| D | 由共价键结合成空间网状结构的晶体,熔点高、硬度大,固体不能导电 | 原子晶体 |
| A. | A | B. | B | C. | C | D. | D |
2.关于阿伏加德罗常数(NA)的下列说法正确的是( )
| A. | 0.1molNa2O2与水反应转移电子数为0.2 NA | |
| B. | 标准状况下,11.2L CCl4中含有的分子数为0.5NA | |
| C. | 1mol S在足量O2中燃烧,转移的电子数为4NA | |
| D. | 0.2 mol Cl2溶于水中,转移电子数为0.2NA |