题目内容
19.某无色溶液中加入过量盐酸有沉淀产生,过滤后向溶液中加入过量纯碱溶液有沉淀产生,下列溶液中符合此条件的是( )①Ag+、Fe3+、NO3- ②Ag+、Al3+、NO3- ③Ag+、Ba2+、NO3-④SiO32-、AlO2-、K+ ⑤Ag+、NH4+、NO3- ⑥SiO32-、K+、Al3+.
| A. | ②③④ | B. | ②③④⑥ | C. | ①②③④⑥ | D. | 各组均符合 |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能相互促进水解等,则离子大量共存,并结合离子的颜色及加入过量的稀盐酸有沉淀生成,过滤后向碱溶液中加入过量的纯碱溶液又有沉淀生成来解答.
解答 解:①Fe3+为黄色,与无色不符,故错误;
②该组离子之间不反应,可大量共存,加盐酸生成AgCl沉淀,滤液加过量纯碱生成氢氧化铝沉淀,故正确;
③该组离子之间不反应,可大量共存,加盐酸生成AgCl沉淀,滤液加过量纯碱生成碳酸钡沉淀,故正确;
④该组离子之间不反应,可大量共存,加盐酸生成硅酸沉淀,滤液加过量纯碱生成氢氧化铝沉淀,故正确;
⑤该组离子之间不反应,可大量共存,加盐酸生成硅酸沉淀,但滤液加纯碱不生成沉淀,故错误;
⑥SiO32-、Al3+相互促进水解,不能大量共存,故错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应及水解反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
2.工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图1:
(1)此流程的第Ⅱ步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),反应的平衡常数随温度的变化如表:
从表可以推断:此反应是放(填“吸”或“放”)热反应.400℃时,H2浓度为2mol/L,CO2浓度为1.5mol/L,H2O浓度为3mol/L,CO浓度为1mol/L,则下一时刻,反应向正向(填”正向”或”逆向”)进行.
(2)在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第Ⅱ步反应,达到平衡后下列关系正确的是AD.
A.2c1=c2=c3 B.2Q1=Q2=Q3 C.α1=α2=α3 D.α1+α2=1
(3)在一个绝热等容容器中,不能判断此流程的第Ⅱ步反应达到平衡的是②③.
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥v(CO2)正=v(H2O)逆
(4)如图2表示此流程的第Ⅱ步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是降低温度、增加水蒸汽的量(或减少氢气的量)(写出两种).若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变).
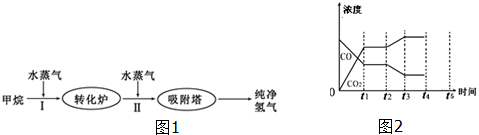
(1)此流程的第Ⅱ步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),反应的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(2)在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第Ⅱ步反应,达到平衡后下列关系正确的是AD.
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |
(3)在一个绝热等容容器中,不能判断此流程的第Ⅱ步反应达到平衡的是②③.
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥v(CO2)正=v(H2O)逆
(4)如图2表示此流程的第Ⅱ步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是降低温度、增加水蒸汽的量(或减少氢气的量)(写出两种).若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变).

10.已知2Al+2NaOH+2H2O→2NaAlO2+3H2↑.对于该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )
| A. | 每生成0.6mol H2,被还原的水分子数目为1.2NA | |
| B. | 有2.7g Al参加反应时,转移的电子数目为0.3NA | |
| C. | 有6.72L H2生成时,反应中转移的电子数目为0.6NA | |
| D. | 溶液中每增加0.1mol AlO${\;}_{2}^{-}$,Na+的数目就增加0.1NA |
7.下列说法正确的是( )
| A. | 可以用过滤的方法分离FeCl3溶液和Fe(OH)3胶体 | |
| B. | Fe(OH)3胶体静置会分层 | |
| C. | HCl、SO2、Fe2+均既有氧化性又有还原性 | |
| D. | CH3COONH4的电离方程式为:CH3COONH4 CH3COO-+NH4+ |
14.下列有关有机物结构和性质的叙述中,错误的是( )
| A. | 有机物CH3-CH2-CH2-CH3的四个碳原子不在一条直线上 | |
| B. | 如果两个有机物互为同系物,则可以推断它们的化学性质相似 | |
| C. | 有机物都是从有机体中分离出来的物质 | |
| D. | 有机物参加的反应较复杂,一般速率慢,常伴有副反应发生 |
5.一种全天候太阳能电化学电池的工作原理如图所示.下列说法错误的是( )
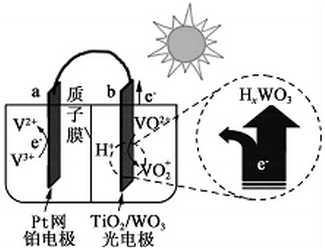

| A. | 该电池与硅太阳能电池供电原理相同 | |
| B. | 光照时,b极周围pH减小 | |
| C. | 光照时,H+由b极室透过质子膜进入a极室 | |
| D. | 夜间无光照时,a为电池的负极 |
12. (1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)
(1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)
E.石墨(s).属于强电解质的是AD,能直接导电的是DE.
(2)有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4.若三种溶液的c(H+)相同,其酸溶液物质的量浓度由大到小顺序为①>②>③.
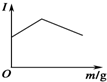
(3)如图是在一定温度下向电解质溶液中加入新物质时溶液的导电性发生的变化,其电流强度(I)随新物质加入量(m)的变化曲线,以下四个导电性实验,其中与如图变化趋势一致的是②(填序号);
①Ba(OH)2溶液中滴入H2SO4溶液至过量
②醋酸溶液中滴入氨水至过量
③澄清石灰水中通入CO2至过量
(4)下表是几种弱酸常温下的电离平衡常数:
①CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为H3PO4>CH3COOH>H2CO3>H2S.
②同浓度的CH3COO-、HCO3-、CO32-、S2-结合H+的能力由强到弱的顺序为S2-、CO32-、HCO3-、CH3COO-.
(5)常温下在pH=5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是10-5-10-9mol•L-1.
 (1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)
(1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)E.石墨(s).属于强电解质的是AD,能直接导电的是DE.
(2)有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4.若三种溶液的c(H+)相同,其酸溶液物质的量浓度由大到小顺序为①>②>③.
(3)如图是在一定温度下向电解质溶液中加入新物质时溶液的导电性发生的变化,其电流强度(I)随新物质加入量(m)的变化曲线,以下四个导电性实验,其中与如图变化趋势一致的是②(填序号);
①Ba(OH)2溶液中滴入H2SO4溶液至过量
②醋酸溶液中滴入氨水至过量
③澄清石灰水中通入CO2至过量
(4)下表是几种弱酸常温下的电离平衡常数:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
②同浓度的CH3COO-、HCO3-、CO32-、S2-结合H+的能力由强到弱的顺序为S2-、CO32-、HCO3-、CH3COO-.
(5)常温下在pH=5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是10-5-10-9mol•L-1.
9.在多电子原子中,轨道能量是由以下哪些因素决定( )
①能层 ②能级 ③电子云的伸展方向 ④电子自旋状态.
①能层 ②能级 ③电子云的伸展方向 ④电子自旋状态.
| A. | ①② | B. | ①②④ | C. | ①②③ | D. | ①③④ |
10.25℃时,有关物质的电离平衡常数如下:
(1)电解质由强至弱的顺序为H2SO3>CH3COOH>H2CO3(用化学式表示,下同).
(2)常温下,0.02mol•L-1的CH3COOH溶液的电离度约为3%,体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-、在溶液中结合H+的能力由大到小的关系为CO32->SO32->CH3COO->HSO3-.
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(2)常温下,0.02mol•L-1的CH3COOH溶液的电离度约为3%,体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-、在溶液中结合H+的能力由大到小的关系为CO32->SO32->CH3COO->HSO3-.