题目内容
1.结构为(CH3)2CHCH(CH3)C(CH3)(CH2CH3)2的某烷烃,其名称为:2,3-二甲基-4,4-二甲基己烷,如果该烷烃是由烯烃与氢气加成反应产生的,则烯烃的可能结构有2种;如果该烷烃是由炔烃与氢气加成反应产生的,则原炔烃可能的结构有1种.分析 最长的碳链有6个碳原子,取代基的位次和最小;写出该有机物的碳架,然后向碳架上添加碳碳双键、碳碳三键,从而分别得出属于烯烃、炔烃的同分异构体数目.
解答 解:最长的碳链有6个碳原子,(CH3)2CHCH(CH3)C(CH3)(CH2CH3)2名称为:2,3-二甲基-4,4-二甲基己烷;(CH3)2CHCH(CH3)C(CH3)(CH2CH3)2的碳架为: ;该碳架上能够添加碳碳双键的方式有:12,56,所以该烯烃的结构有2种;
;该碳架上能够添加碳碳双键的方式有:12,56,所以该烯烃的结构有2种;
添加碳碳三键时,只有56号碳原子能够添加碳碳三键,故答案为:2,3-二甲基-4,4-二甲基己烷;2;1.
点评 本题考查了有机物的命名、有机物结构简式的书写,题目难度中等,注意掌握常见有机物的命名原则,明确有机反应原理,能够正确书写满足条件的有机物的结构简式.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
10.已知2Al+2NaOH+2H2O→2NaAlO2+3H2↑.对于该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )
| A. | 每生成0.6mol H2,被还原的水分子数目为1.2NA | |
| B. | 有2.7g Al参加反应时,转移的电子数目为0.3NA | |
| C. | 有6.72L H2生成时,反应中转移的电子数目为0.6NA | |
| D. | 溶液中每增加0.1mol AlO${\;}_{2}^{-}$,Na+的数目就增加0.1NA |
12.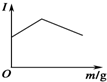 (1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)
(1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)
E.石墨(s).属于强电解质的是AD,能直接导电的是DE.
(2)有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4.若三种溶液的c(H+)相同,其酸溶液物质的量浓度由大到小顺序为①>②>③.
(3)如图是在一定温度下向电解质溶液中加入新物质时溶液的导电性发生的变化,其电流强度(I)随新物质加入量(m)的变化曲线,以下四个导电性实验,其中与如图变化趋势一致的是②(填序号);
①Ba(OH)2溶液中滴入H2SO4溶液至过量
②醋酸溶液中滴入氨水至过量
③澄清石灰水中通入CO2至过量
(4)下表是几种弱酸常温下的电离平衡常数:
①CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为H3PO4>CH3COOH>H2CO3>H2S.
②同浓度的CH3COO-、HCO3-、CO32-、S2-结合H+的能力由强到弱的顺序为S2-、CO32-、HCO3-、CH3COO-.
(5)常温下在pH=5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是10-5-10-9mol•L-1.
 (1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)
(1)下列物质中:A.NaCl(s) B.蔗糖(s) C.SO2(g) D.KNO3(熔融)E.石墨(s).属于强电解质的是AD,能直接导电的是DE.
(2)有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4.若三种溶液的c(H+)相同,其酸溶液物质的量浓度由大到小顺序为①>②>③.
(3)如图是在一定温度下向电解质溶液中加入新物质时溶液的导电性发生的变化,其电流强度(I)随新物质加入量(m)的变化曲线,以下四个导电性实验,其中与如图变化趋势一致的是②(填序号);
①Ba(OH)2溶液中滴入H2SO4溶液至过量
②醋酸溶液中滴入氨水至过量
③澄清石灰水中通入CO2至过量
(4)下表是几种弱酸常温下的电离平衡常数:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
②同浓度的CH3COO-、HCO3-、CO32-、S2-结合H+的能力由强到弱的顺序为S2-、CO32-、HCO3-、CH3COO-.
(5)常温下在pH=5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是10-5-10-9mol•L-1.
9.在多电子原子中,轨道能量是由以下哪些因素决定( )
①能层 ②能级 ③电子云的伸展方向 ④电子自旋状态.
①能层 ②能级 ③电子云的伸展方向 ④电子自旋状态.
| A. | ①② | B. | ①②④ | C. | ①②③ | D. | ①③④ |
16.下列分子式肯定属于饱和烃的是( )
| A. | C8H16 | B. | C5H8 | C. | C7H16 | D. | C7H14 |
6.下列说法正确的是( )
| A. | 氯化钠溶液能导电,所以氯化钠溶液是电解质 | |
| B. | NaCl固体不导电,熔融的KCl能导电,所以前者是非电解质,而后者是电解质 | |
| C. | SO2、Na2O的水溶液都能导电,所以它们都是电解质 | |
| D. | 在溶于水或熔融状态下能够自身发生电离的化合物一定是电解质 |
13.下列说法正确的是( )
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 可以用丁达尔现象区别硫酸铜溶液和氢氧化铁胶体 | |
| C. | 由0.1 mol氯化铁制取的氢氧化铁胶体中,氢氧化铁胶粒数目为0.1NA(设NA表示阿伏加德罗常数的值) | |
| D. | 向1 mol•L-1氯化铁溶液中加入少量的NaOH溶液制取氢氧化铁胶体 |
10.25℃时,有关物质的电离平衡常数如下:
(1)电解质由强至弱的顺序为H2SO3>CH3COOH>H2CO3(用化学式表示,下同).
(2)常温下,0.02mol•L-1的CH3COOH溶液的电离度约为3%,体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-、在溶液中结合H+的能力由大到小的关系为CO32->SO32->CH3COO->HSO3-.
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(2)常温下,0.02mol•L-1的CH3COOH溶液的电离度约为3%,体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-、在溶液中结合H+的能力由大到小的关系为CO32->SO32->CH3COO->HSO3-.
11.下列化学反应中,属于氧化还原反应的是( )
| A. | CuSO4+2NaOH═Cu(OH)2↓+Na2SO4 | B. | Al2O3+6HCl═2AlCl3+3H2O | ||
| C. | Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO | D. | 2Na2O2+2CO2═2Na2CO3+O2 |