题目内容
在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:
PCl3(g)+ Cl2(g)? PCl5(g);5min末达到平衡,有关数据如右表。
| | PCl3(g) | Cl2(g) | PCl5(g) |
| 初始浓度(mol?L—1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol?L—1) | C1 | C2 | 0.4 |
下列判断不正确的是
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5min内,v(PCl3)="0.08" mol?L-1?min-1
C.当容器中为1.2mol时,可逆反应达到平衡状态
D.平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol?L—1
A
解析试题分析:A、升高温度,K值减小,则平衡向左移动,所以此正反应为放热反应;B、根据方程式算出PCl3的浓度改变量为0.4mol/L,所以其速率为0.08mol/(L. min);C、根据三段法计算;D、减少了一半的反应物, 容器的体积不变,压强减小平衡向体积增大的反向进行,所以PCl3的浓度较之前的一半还小。
考点:本题考查化学反应速率及化学平衡相关知识,涉及化学反应速率计算,化学平衡移动等。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案下列事实不能用勒夏特列原理解释的是( )
A.氯水中有平衡:Cl2+H2O HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 |
B.对CO(g)+NO2(g) CO2(g)+NO(g),平衡体系增大压强可使颜色变深 CO2(g)+NO(g),平衡体系增大压强可使颜色变深 |
C.对2NO2(g)  N2O4(g), 升高温度平衡体系颜色变深 N2O4(g), 升高温度平衡体系颜色变深 |
| D.SO2催化氧化成SO3的反应,往往加入过量的空气 |
COCl2(g) CO(g)+Cl2(g); △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g); △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
| A.①②④ | B.①④⑥ | C.②③⑥ | D.③⑤⑥ |
一定条件下,在2L密闭容器中加入某A气体8.0mol,在4s时测得A气体的物质的量为5.6mol,则此4s内用A表示该反应速率正确的是: ( )
| A.0.3 mol·L-1s-1 | B.0.6 mol·L-1s-1 |
| C.1.0 mol·L-1s-1 | D.0.7 mol·L-1s-1 |
最近,各国科学家联合研制成功一种新型催化剂,可在常压下将二氧化碳与氢气混合转化为甲烷。在VL容器中进行该转化,相关情况如图所示。下列有关说法不正确的是
A.101KPa、120℃时,该反应的平衡常数表达式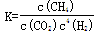 |
| B.断裂lmolC=O、2molH—H所吸收的能量小于形成2molC—H、2molO—H所释放的能量 |
C.300℃时,从反应开始达到平衡的这段时间,化学反应速率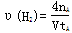 |
| D.其它条件不变,减小容器体积,二氧化碳的平衡转化率增大,平衡常数不变 |
在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g) CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是
A.平衡常数K= |
| B.该反应在T1时的平衡常数比T2时的小 |
| C.任意时刻,T2温度下的反应速率均大于T1温度下的速率 |
D.处于A点的反应体系从T1变到T2,达到平衡时 增大 增大 |
温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生PCl5(g)  PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是
PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是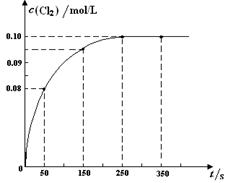
| A.反应在0 ~50 s 的平均速率v(Cl2) =1.6×10-3mol/(L·s) |
| B.该温度下,反应的平衡常数K = 0.025 |
| C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则该反应的ΔH <0 |
| D.反应达平衡后,再向容器中充入 1 mol PCl5,该温度下再达到平衡时,0.1 mol/L<c(Cl2)<0.2 mol/L |
在密闭容器中通入物质的量浓度均0.1mol·L-1的CH4与CO2,在一定条件下发生反应: ,测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法一定正确的是
,测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法一定正确的是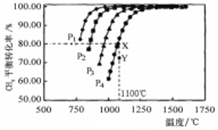
| A.上述反应的△H>0 |
| B.压强P1>P2>P3>P4 |
| C.1100℃该反应的平衡常数为64mol2·L-1 |
| D.压强为P4时,在Y点:v(正)<v(逆) |
一定温度下,在密闭容器内有如下化学反应平衡:CO+H2O(g)  H2+CO2。向容器内加入1molCO和1mol H2O(g)时,生成2/3mol CO2如果通入的H2O(g)改为4mol时,在上述条件下,生成CO2的物质的量为
H2+CO2。向容器内加入1molCO和1mol H2O(g)时,生成2/3mol CO2如果通入的H2O(g)改为4mol时,在上述条件下,生成CO2的物质的量为
| A.0.5mol | B.0.6mol | C.0.9mol | D.2.5mol |