��Ŀ����
��12�֣������ҹ�Ŀǰ����ҵ��չ�ٶ�,Ԥ��2020����������������2����,�й��ѳ�Ϊȫ�����������г�����ˣ������Ч���������ŷŵ�β��������Ҫ�����о���һ����Ҫ���⡣Ŀǰ���������̳����ô�������β���е�NO��COת����CO2��N2����ѧ����ʽ���£�
2NO��2CO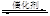 2CO2��N2��Ϊ�о������߸�ת�����̷�Ӧ���ʣ�ij���������������ʵ��̽����
2CO2��N2��Ϊ�о������߸�ת�����̷�Ӧ���ʣ�ij���������������ʵ��̽����
�����ϲ��ġ��ٲ�ͬ�Ĵ�����ͬһ��Ӧ�Ĵ�Ч�ʲ�ͬ��
��ʹ����ͬ�Ĵ������������������ʱ�������ıȱ�����Դ�Ч����Ӱ�졣
��ʵ����ơ�������Ϊ̽��ijЩ�������������β��ת����Ӧ���ʵ�Ӱ����ɣ���������¶Ա�ʵ�顣
��1���������ʵ����Ʊ������в�Ҫ���ո�
| ʵ���� | ʵ��Ŀ�� | T/�� | NO��ʼŨ�� mol/L | CO��ʼŨ�� mol/L | ͬ�ִ����ıȱ���� m2/g |
| �� | Ϊ����ʵ�������� | 280 | 6.50��10-3 | 4.00��10-3 | 80 |
| �� | | | | | 120 |
| �� | ̽���¶ȶ�β��ת�����ʵ�Ӱ�� | 360 | | | 80 |
��2������ڢ���ʵ���У���ƽ��ʱNO��Ũ��Ϊ__________________��
��3�������ߢ��֪����������ȱ����������β��ת������_____________
�����������С��������Ӱ�족����
��1��
��2��3.50��10-3 mol/L��3�֣� ��3������2�֣�ʵ���� ʵ��Ŀ�� T/�� NO��ʼŨ��
mol/LCO��ʼŨ��
mol/Lͬ�ִ����ıȱ����
m2/g�� �� ̽�������ȱ������β��ת�����ʵ�Ӱ�죨2�֣� 280
��1�֣�6.50��10-3
��1�֣�4.00��10-3
��1�֣� �� 6.50��10-3
��1�֣�4.00��10-3
��1�֣�
���������������1�����ڢ������ͬ�ִ����ıȱ����m2/g��ͬ������Ӧ������ͬ�����Ԣ���̽�������ȱ������β��ת�����ʵ�Ӱ�졣����Ķ��͢�����ͬ�ģ����¶���280�棻NO��ʼŨ����6.50��10-3mol/L��CO��ʼŨ����4.00��10-3mol/L���������Ƚϣ����¶Ȳ�ͬ����ͬ�ִ����ıȱ������ͬ����ˢ���̽���¶ȶ�β��ת�����ʵ�Ӱ�죬����Ķ��͢���ͬ��NO��ʼŨ��6.50��10-3mol/L��CO��ʼŨ��4.00��10-3mol/L����2�����������֪�ڷ�Ӧ��ʼʱc(CO)=4.0��10-3mol/L���ڴﵽƽ��ʱc(CO)=1.0��10-3mol/L��Ũ�ȼ�С��c(CO)=3.0��10-3mol/L�����ݷ�Ӧ����ʽ��CO��NO��Ũ�ȹ�ϵ��֪��c(NO)=3.0��10-3mol/L�����Դ�ƽ��ʱNO��Ũ��Ϊ6.50��10-3 mol/L��3.0��10-3mol/L=3.50��10-3 mol/L����3�������ߢ��֪����������ȱ�������ﵽƽ������Ҫ��ʱ�����̣����Ǵﵽƽ��ʱ����β��ת���ʲ��䡣������������ȱ����������β��ת����������
���㣺�����¶ȡ������ı������β����������Ӱ���֪ʶ��

��14�֣� 2SO2(g)+ O2 (g)  2 SO3 (g)�������������Ҫ��Ӧ֮һ���±���ԭ������V(SO2):V(O2):V(N2)=7:11:82Ͷ�ϣ���1��01��105Paʱ����ͬ�¶���SO2��ƽ��ת���ʡ�
2 SO3 (g)�������������Ҫ��Ӧ֮һ���±���ԭ������V(SO2):V(O2):V(N2)=7:11:82Ͷ�ϣ���1��01��105Paʱ����ͬ�¶���SO2��ƽ��ת���ʡ�
| �¶�/�� | 400 | 500 | 600 |
| SO2ת����/% | 99��2 | 93��5 | 73��7 |
��2��400�棬1��01��105Paʱ������10 mol SO2��ԭ����ͨ��һ�ܱ������н��з�Ӧ��ƽ��ʱSO2�����ʵ�����______mol��
��3�����᳧β������Ҫ�ɷ�SO2��O2��N2���е�Ũ��SO2�������кܶ����
���ð�ˮ��������β������SO2�백ˮǡ�÷�Ӧ�õ����Ե�(NH4)2SO3��Һʱ�����йظ���Һ�����й�ϵ��ȷ����______������ţ���
a�� c + c(NH3?H2O)=" 2[c()+" c()+ c(H2SO3)]
b�� c()+ c(H+)=" c()+" c()+ c(OH-)
c�� c()> c() > c(OH-) > c(H+)
���� MnO2��ˮ������Һ��������β��������MnSO4��
i�� �õ�MnSO4�Ļ�ѧ����ʽ��______��
ii�������չ�������MnSO4ʱ����Һ��pH�仯������ͼ�ף�SO2����������ҺpH�Ĺ�ϵ��ͼ�ҡ�


ͼ����pH�仯����Ϊ�������в���SO2ת��ΪH2SO4������H2SO4��Ӧ�Ļ�ѧ����ʽ��______����ͼ�ҿ�֪pH�Ľ���______SO2�����գ�������ڡ������ڡ������û�ѧƽ���ƶ�ԭ��������ԭ����______��
2012��2��27���������ƽ��롰200��������ʱ����������β���ѳ�Ϊ��Ҫ�Ŀ�����Ⱦ�
��1��������ȼ������ʱ����Ӧ��N2(g)+O2(g) 2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��T��ʱ����2L�ܱ������г���4mol N2��6molO2��5min���ƽ��ʱNO���ʵ���Ϊ4mol���÷�Ӧ������v(N 2)Ϊ ������������µ�ƽ�ⳣ����д��������̣���
2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��T��ʱ����2L�ܱ������г���4mol N2��6molO2��5min���ƽ��ʱNO���ʵ���Ϊ4mol���÷�Ӧ������v(N 2)Ϊ ������������µ�ƽ�ⳣ����д��������̣���
��2�����º��ݣ���˵����Ӧ 2NO(g)  N2(g)+O2(g) �ﵽƽ����� ������ţ���
N2(g)+O2(g) �ﵽƽ����� ������ţ���
| A��NO��N2��O2��Ũ��֮��Ϊ2��1��1 |
| B��N2��Ũ�Ȳ��ٷ����仯 |
| C����λʱ��������2 mol NO��ͬʱ����1 mol N2 |
| D�������������ܶȲ��ٷ����仯 |
����֪��N2(g)+ O2(g) = 2NO(g) ��H = +180.5kJ/mol
H2(g)+1/2O2(g) = H2O(l) ��H = ��285.8kJ/mol
��H2(g)��NO(g)��Ӧ����N2(g)��H2O(l)���Ȼ�ѧ����ʽΪ ��
�ڵ�����һ��ʱ�������������ı���������ѧ��Ӧ���ʡ���ͼ�Ƿ�Ӧ��2NO(g) + 2CO(g)
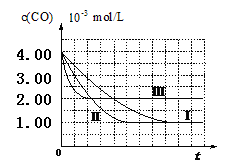
 2CO2(g)+ N2(g) ��NO��Ũ�����¶�(T)�����������(S)��ʱ��(t)�ı仯���ߣ��ݴ��жϸ÷�Ӧ�ġ�H 0 (�����������������ȷ����)���������ı����S1��S2 ������ͼ�л���NO��Ũ����T1��S2�����´ﵽƽ������еı仯���ߣ���ע��������
2CO2(g)+ N2(g) ��NO��Ũ�����¶�(T)�����������(S)��ʱ��(t)�ı仯���ߣ��ݴ��жϸ÷�Ӧ�ġ�H 0 (�����������������ȷ����)���������ı����S1��S2 ������ͼ�л���NO��Ũ����T1��S2�����´ﵽƽ������еı仯���ߣ���ע��������
ijʵ��С������ȡ����ͭ��֤������ͭ�ܼӿ�����صķֽ⣬����������ʵ�飺
��һ����ȡ����ͭ
�ٳ�ȡ2 gCuSO4·5H2O��ϸ�����ձ�����10 mL����ˮ�ܽ⣻
��������CuSO4��Һ����μ���NaOH��Һ��ֱ�����ٲ���������Ȼ�����û�������������ȫ����Ϊ��ɫ��
�۽���������û������ˡ�ϴ�ӣ����ɺ���ϸ���á�
�ش��������⣺
��1������ʵ�鲽������Ҫʹ�ò���������_______________����ʵ����ţ���������м�������������������___________________��
��2���������ϴ�ӳ����IJ�����___________________________________��
������֤������ͭ�ܼӿ�����صķֽⲢ��������̵Ĵ�Ч�����бȽ�
����ͼװ�ý���ʵ�飬ʵ��ʱ��������25 mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԣ�������ݼ��±���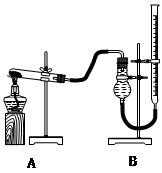
| ʵ����� | KClO3���� | ������������ | �������� |
| �� | 1.2 g | ���������� | |
| �� | 1.2 g | CuO 0.5 g | |
| �� | 1.2 g | MnO2 0.5 g | |
��3������ʵ���еġ�����������ָ_____________��
��4����ʵ��װ��ͼ������װ��B�ɸ���ܡ��齺�ܺ�50 mL�ζ��ܸ������װ���ɣ��˴����õζ�����___________�����ʽ����ʽ�����ζ��ܣ�
��5����Ҫ��ȡʵ����и�������ռ������������Ӧע�� ____________________
____________________________________________________��
��Ϊ̽��CuO��ʵ������Ƿ�������ã��貹������ʵ�飨����д�������������
a��_______________________________��
b��CuO�Ļ�ѧ������û�иı�
25��ʱ��ˮ�ĵ���ﵽƽ�⣺H2O H����OH��������������ȷ���ǣ� ��
H����OH��������������ȷ���ǣ� ��
| A����ˮ�м��백ˮ��ƽ�������ƶ���c(OH��)���� |
| B����ˮ�м������������������ƣ�c(H��)����KW���� |
| C����ˮ�м�����������CH3COONa��ƽ�������ƶ���c(H��)���� |
| D����ˮ���ȣ�KW����pH���� |
 2NO(g)�����ɵ�NO������β������Ҫ��Ⱦ�T ��ʱ����5L�ܱ������г���6.5 molN2��7.5 molO2����5 minʱ��Ӧ�ﵽƽ��״̬����ʱ������NO�����ʵ�����5 mol�������Ǻ�����Ӧ������
2NO(g)�����ɵ�NO������β������Ҫ��Ⱦ�T ��ʱ����5L�ܱ������г���6.5 molN2��7.5 molO2����5 minʱ��Ӧ�ﵽƽ��״̬����ʱ������NO�����ʵ�����5 mol�������Ǻ�����Ӧ������
 2CO2(g) + N2(g) �У�NO��Ũ��[c(NO)]���¶ȣ�T���������������S����ʱ�䣨t���ı仯���ߡ�
2CO2(g) + N2(g) �У�NO��Ũ��[c(NO)]���¶ȣ�T���������������S����ʱ�䣨t���ı仯���ߡ�