��Ŀ����
2012��2��27���������ƽ��롰200��������ʱ����������β���ѳ�Ϊ��Ҫ�Ŀ�����Ⱦ�
��1��������ȼ������ʱ����Ӧ��N2(g)+O2(g) 2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��T��ʱ����2L�ܱ������г���4mol N2��6molO2��5min���ƽ��ʱNO���ʵ���Ϊ4mol���÷�Ӧ������v(N 2)Ϊ ������������µ�ƽ�ⳣ����д��������̣���
2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��T��ʱ����2L�ܱ������г���4mol N2��6molO2��5min���ƽ��ʱNO���ʵ���Ϊ4mol���÷�Ӧ������v(N 2)Ϊ ������������µ�ƽ�ⳣ����д��������̣���
��2�����º��ݣ���˵����Ӧ 2NO(g)  N2(g)+O2(g) �ﵽƽ����� ������ţ���
N2(g)+O2(g) �ﵽƽ����� ������ţ���
| A��NO��N2��O2��Ũ��֮��Ϊ2��1��1 |
| B��N2��Ũ�Ȳ��ٷ����仯 |
| C����λʱ��������2 mol NO��ͬʱ����1 mol N2 |
| D�������������ܶȲ��ٷ����仯 |
����֪��N2(g)+ O2(g) = 2NO(g) ��H = +180.5kJ/mol
H2(g)+1/2O2(g) = H2O(l) ��H = ��285.8kJ/mol
��H2(g)��NO(g)��Ӧ����N2(g)��H2O(l)���Ȼ�ѧ����ʽΪ ��
�ڵ�����һ��ʱ�������������ı���������ѧ��Ӧ���ʡ���ͼ�Ƿ�Ӧ��2NO(g) + 2CO(g)
 2CO2(g)+ N2(g) ��NO��Ũ�����¶�(T)�����������(S)��ʱ��(t)�ı仯���ߣ��ݴ��жϸ÷�Ӧ�ġ�H 0 (�����������������ȷ����)���������ı����S1��S2 ������ͼ�л���NO��Ũ����T1��S2�����´ﵽƽ������еı仯���ߣ���ע��������
2CO2(g)+ N2(g) ��NO��Ũ�����¶�(T)�����������(S)��ʱ��(t)�ı仯���ߣ��ݴ��жϸ÷�Ӧ�ġ�H 0 (�����������������ȷ����)���������ı����S1��S2 ������ͼ�л���NO��Ũ����T1��S2�����´ﵽƽ������еı仯���ߣ���ע��������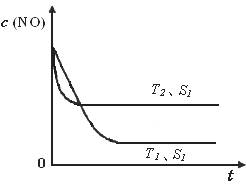
��1��0.2mol/(L��min)
N2(g)+O2(g) 2NO(g)
2NO(g)
��ʼŨ��(mol��L-1) 2.0 3.0 0
ת��Ũ��(mol��L-1) 1.0 1.0 2.0
ƽ��Ũ��(mol��L-1) 1.0 2.0 2.0
ƽ�ⳣ��K=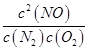 =
=
��2��BC
��3����2H2(g)+2NO(g)=N2(g)+2H2O(l) ��H=-752.1kJ/mol �ڣ�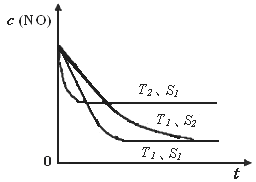
���������������1�����ݶ���ʽ��ֻ����ֱ�Ӽ���v(NO)=4mol��2L��5min=0.4mol/(L��min)���ٸ���ϵ���ȣ���Ӽ���v(N2)= v(NO)/2=0.2mol/(L��min)������ʼ���仯��ƽ��Ũ�ȹ�ϵ��֪��
N2(g)+O2(g) 2NO(g)
2NO(g)
��ʼŨ��/mol��L��1 2 3 0
�仯Ũ��/mol��L��1 1 1 2
ƽ��Ũ��/mol��L��1 1 2 2
K=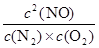 =
=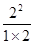 =2
=2
��2��A���˵���ﵽƽ�⣬��ΪNO��N2��O2�ı仯Ũ��֮��Ϊ2��1��1����ƽ��Ũ��֮�Ȳ�һ������ϵ��֮�ȣ�B����˵���ﵽƽ�⣬N2��Ũ�Ȳ��ٷ����仯��˵��N2���������ʵ����������ʣ����淴Ӧ���ʵ�������Ӧ���ʣ�C����˵���ﵽƽ�⣬��Ϊv(NO)����/v(N2)����=2/1�����v(NO)����/v(N2)����=2/1����v(N2)����= v(N2)������������Ӧ���ʵ����淴Ӧ���ʣ�D���˵���ﵽƽ�⣬����ֶ������壬���������������غ㣬�����ݻ����䣬�����Ƿ�ﵽƽ�⣬���������ܶ�һ�����䣻��3���ٵ�2���Ȼ�ѧ����ʽ��2����1���Ȼ�ѧ����ʽ����ԼȥO2(g)����2H2(g)+2NO(g)=2H2O(l)+N2(g) ��H="[(��285.8)" ��2��(+180.5)]kJ/mol=��752.1kJ/mol���������¶�������Ӧ���ʣ����̴ﵽƽ���ʱ�䣬�ɴ��ƶ�ͼ���¶�T1<T2����ͼ��T1��T2ʱc(NO)������������ƽ�������ȷ����ƶ���c(NO)����˵��ƽ�����淴Ӧ�����ƶ������淴Ӧ�����ȷ�Ӧ����������Ӧ�Ƿ��ȷ�Ӧ������Ӧ�ġ�H <0���ۻ�ͼҪ�㣺a�������T1��S1ʱ��ͬ��b��ƽ���� T1��S1ʱ������ΪT1��S1��T1��S2���Ǽ�С�������������Ӧ���ʼ�С���ﵽƽ���ʱ������ c��ƽ��ʱc(NO)��T1��S1ʱ��ͬ����Ϊ��������ʹƽ���ƶ���
���㣺���йػ�ѧ��Ӧ���ʡ���ѧƽ�⡢�Ȼ�ѧ����ʽ�Ļ�ѧ��Ӧԭ���⣬����ƽ����Ӧ���ʵ�ֱ�Ӻͼ�Ӽ��㷽������ѧƽ�ⳣ���ļ�����̡���ѧƽ��״̬�ı�־����˹���ɵ�Ӧ�á�����Ũ��-ʱ��ͼ���ƶ��ʱ�������������ı�һ������ʱ��Ũ��-ʱ��ͼ��ȳ���������ʽ��

��֪��CO(g)+H2O(g)  CO2(g)+H2(g) ��H=Q����ƽ�ⳣ�����¶ȱ仯���±���ʾ��
CO2(g)+H2(g) ��H=Q����ƽ�ⳣ�����¶ȱ仯���±���ʾ��
| �¶�/�� | 400 | 500 | 850 |
| ƽ�ⳣ�� | 9.94 | 9 | 1 |
��1��������Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ���÷�Ӧ��Q 0��
��2��850��ʱ�����Ϊ10L��Ӧ���У�ͨ��һ������CO��H2O(g)������������Ӧ��CO��H2O(g)Ũ�ȱ仯��ͼ��ʾ����0~4minʱƽ����Ӧ����v(CO)= ��
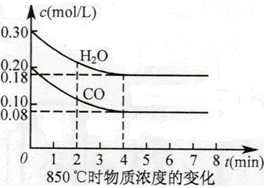
��3������500 ��ʱ���У���CO��H2O(g)����ʼŨ�Ⱦ�Ϊ0.020mol/L���������£�CO�����ת����Ϊ ��
��4������850��ʱ���У�����ʼʱCO��H2O(g)��Ϊ1mol������ˮ�������������Ϊxƽ��ʱCO��ת����Ϊy�����Ƶ�y��x�仯�ĺ�����ϵʽΪ ��
��5��ij�绯ѧװ�ÿ�ʵ��2CO2=2CO+O2��ת����ʹCO�ظ�ʹ�á���֪�÷�Ӧ������ӦΪ4OH--4e-=2H2O+O2����������ӦʽΪ ��
��6���������������Ʒ�Ӧ2CO=2C+O2(��H>0)������CO����Ⱦ�����ж�������Ӧ�ܷ��� (����ܡ������ܡ�)�������� ��
Ϊ�������÷Ϸ�����������V2O5��VOSO4�������Բ�������������Ա����������һ�����ӽ��������շ����¹��ա���֪��V���γ�VO2+��VO2+��VO3-�ȶ������ӣ����ֺ���������ˮ�е��ܽ������±���ʾ��
| ���� | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| �ܽ��� | ���� | ���� | ���� | ���� |
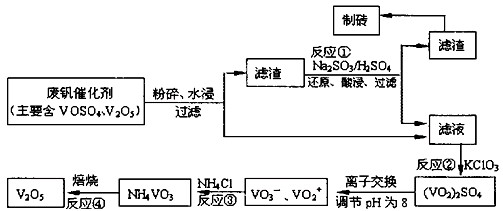
�ù��յ���Ҫ�������£�
��ش��������⣺
��1����ҵ����V2O5ұ���������������ȼ������䷴Ӧ�Ļ�ѧ����ʽΪ ��
��2����Ӧ�ٵ�Ŀ���� ��
��3������NaOH��Һ����pH����ת���ڵ����ӷ���ʽΪ ��
��4��ʵ������ʵ�ַ�Ӧ��������Ҫ���������żܡ������ǡ��ƾ����⣬�ز����ٵ��� ��
��5��V2O5Ϊ���Ṥҵ�Ӵ����е���Ҫ�����������ӦΪ2SO2(g)��O2(g)
 2SO3(g) ��H��0�����ݻ�Ϊ2.0 L���ܱ������г���2 mol SO2��1 mol O2��һ�������´ﵽƽ�⣬SO3���������Ϊ
2SO3(g) ��H��0�����ݻ�Ϊ2.0 L���ܱ������г���2 mol SO2��1 mol O2��һ�������´ﵽƽ�⣬SO3���������Ϊ ��
���ٸ������·�Ӧ2SO2(g)��O2(g)
 2SO3(g) ��ƽ�ⳣ��Ϊ_____��
2SO3(g) ��ƽ�ⳣ��Ϊ_____�������д�ʩ��ʹ
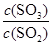 �������_____��
�������_____��A�������¶�
B�������¶Ⱥ��ݻ����䣬�ٳ���2 mol He
C�������¶Ⱥ��ݻ����䣬�ٳ���2 mol SO2��1 mol O2
D������V2O5������������������������
������ЧӦ����ȫ���ע�Ļ�������֮һ��CO2��Ŀǰ�����к�����ߵ�һ���������塣��ˣ����ƺ�����CO2�ǽ������ЧӦ����Ч;����
��1������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO(g)+H2O(g) CO2(g)+H2(g)���õ������������ݣ�
CO2(g)+H2(g)���õ������������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
�� ʵ��1������ƽ�ⳣ��K= ������С������λ���֣���
�� ʵ��3�У���ƽ��ʱ��CO��ת���ʴ���ˮ��������a/b ��ֵ �������ֵ��ȡֵ��Χ����
�� ʵ��4����900��ʱ���ڴ������м���10molCO��5molH2O��2molCO2��5molH2�����ʱv(��) v(��)���<������>������=������
��2��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10��9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10��4mo1/L�������ɳ�������CaCl2��Һ����СŨ��Ϊ ��
��3����֪BaSO4(s) + 4C(s) ="4CO(g)" + BaS(s) ��H1 =+571.2kJ/mol��
BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s) ��H2="+226.2" kJ/mol��
��ӦC(s) + CO2(g) = 2CO(g)�ġ�H3= kJ/mol��
 ��4��Ѱ������Դ�ǽ������ЧӦ��һ����Ҫ˼·�����������LiFePO4��һ��������������ӵ�أ��ܷ�ӦΪ��FePO4+Li LiFePO4������еĹ������ʿɴ���Li+����õ�طŵ�ʱ������������Ӧʽ�ֱ�Ϊ�� �� �����øõ�ص������ˮ�����ص缫��Ϊ���Ե缫������������������3360mL���壨��״��������ʱ���õ������﮵�����Ϊ ��(Li�����ԭ������ԼΪ7.0)
��4��Ѱ������Դ�ǽ������ЧӦ��һ����Ҫ˼·�����������LiFePO4��һ��������������ӵ�أ��ܷ�ӦΪ��FePO4+Li LiFePO4������еĹ������ʿɴ���Li+����õ�طŵ�ʱ������������Ӧʽ�ֱ�Ϊ�� �� �����øõ�ص������ˮ�����ص缫��Ϊ���Ե缫������������������3360mL���壨��״��������ʱ���õ������﮵�����Ϊ ��(Li�����ԭ������ԼΪ7.0) ��12�֣������ҹ�Ŀǰ����ҵ��չ�ٶ�,Ԥ��2020����������������2����,�й��ѳ�Ϊȫ�����������г�����ˣ������Ч���������ŷŵ�β��������Ҫ�����о���һ����Ҫ���⡣Ŀǰ���������̳����ô�������β���е�NO��COת����CO2��N2����ѧ����ʽ���£�
2NO��2CO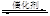 2CO2��N2��Ϊ�о������߸�ת�����̷�Ӧ���ʣ�ij���������������ʵ��̽����
2CO2��N2��Ϊ�о������߸�ת�����̷�Ӧ���ʣ�ij���������������ʵ��̽����
�����ϲ��ġ��ٲ�ͬ�Ĵ�����ͬһ��Ӧ�Ĵ�Ч�ʲ�ͬ��
��ʹ����ͬ�Ĵ������������������ʱ�������ıȱ�����Դ�Ч����Ӱ�졣
��ʵ����ơ�������Ϊ̽��ijЩ�������������β��ת����Ӧ���ʵ�Ӱ����ɣ���������¶Ա�ʵ�顣
��1���������ʵ����Ʊ������в�Ҫ���ո�
| ʵ���� | ʵ��Ŀ�� | T/�� | NO��ʼŨ�� mol/L | CO��ʼŨ�� mol/L | ͬ�ִ����ıȱ���� m2/g |
| �� | Ϊ����ʵ�������� | 280 | 6.50��10-3 | 4.00��10-3 | 80 |
| �� | | | | | 120 |
| �� | ̽���¶ȶ�β��ת�����ʵ�Ӱ�� | 360 | | | 80 |
��2������ڢ���ʵ���У���ƽ��ʱNO��Ũ��Ϊ__________________��
��3�������ߢ��֪����������ȱ����������β��ת������_____________
�����������С��������Ӱ�족����
ijͬѧ��MnO2��CuO��Fe2O3��Cr2O3����������ȷֽⷴӦ�еĴ����ý������о���ʵ�������������±����ͱ�ʵ����й����⣬����գ�
| ʵ���� | KClO3��g�� | ������ | �������壨mL����������Ϊ����� | ��ʱ��s�� | ||
| ��ѧʽ | ������g�� | ʵ�ʻ��� | ||||
| 1 | 0.6 | �� | �� | �� | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | �쳣 | 67.2 | 188.3 |
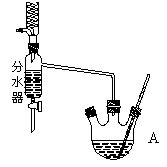
��1����ʵ���װ������ͼ��������ɣ�����ȷ�Ľӿ�����˳��Ϊ ��
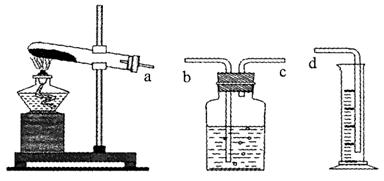
��2��Ϊ֤�����2��ʵ����MnO2�����ã���Ҫ�ⶨ��Ӧʣ������MnO2��������ʵ��IJ���˳���ǣ��ܽ�� ��
��3��д��ʵ������ͨ�����2��ȡ�����Ļ�ѧ����ʽ��
��4�����ϱ�ʵ�����ݷ���������������ȷֽ��д����õ����ʣ�����������Ӵ�С��˳��Ϊ �������ʵĻ�ѧʽ����
��5���ڽ��б��5��ʵ��ʱ���д̼��ԵĻ���ɫ�������������������� ���ѧʽ�������� ��ֽ��������壬�����쳣���������ԭ���� ��
�����Ƕ�Ԫ���ᣬ���������Һ�����ԡ���0.1mol��L��1 KHC2O4��Һ�У����й�ϵ��ȷ����
| A��c(K+)+c(H+) = c(HC2O4��)+c(OH��)+c(C2O42��) |
| B��c(HC2O4��)+c (C2O42��) =" 0.1" mol��L��1 |
| C��c(C2O42��) < c(H2C2O4) |
| D��c(K+) = c(H2C2O4)+c(HC2O4��)+c(C2O42��) |
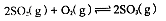 ����Ӧ�����ϵSO3�İٷֺ������¶ȵĹ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺
����Ӧ�����ϵSO3�İٷֺ������¶ȵĹ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺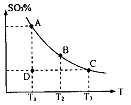
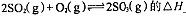 0���>����<���������ں��º��������£�������Ӧ�ﵽƽ�⣬�ٸ���ƽ����ϵ��ͨ��SO3���壬�����ڵ�ѹǿ �����������С�����䡱����ƽ�� �ƶ����������Ӧ���Ρ������淴Ӧ�����������ں��º�ѹ�����£�������Ӧ�ﵽƽ�⣬�ٸ���ƽ����ϵ��ͨ�˴�����������ϵ���´ﵽƽ�⣬��ƽ����ԭƽ����Ƚϣ�SO2�����ʵ��� __�����������С�����䡱����O2�����ʵ���Ũ�� �����������С�����䡱����
0���>����<���������ں��º��������£�������Ӧ�ﵽƽ�⣬�ٸ���ƽ����ϵ��ͨ��SO3���壬�����ڵ�ѹǿ �����������С�����䡱����ƽ�� �ƶ����������Ӧ���Ρ������淴Ӧ�����������ں��º�ѹ�����£�������Ӧ�ﵽƽ�⣬�ٸ���ƽ����ϵ��ͨ�˴�����������ϵ���´ﵽƽ�⣬��ƽ����ԭƽ����Ƚϣ�SO2�����ʵ��� __�����������С�����䡱����O2�����ʵ���Ũ�� �����������С�����䡱����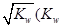 ��ˮ�����ӻ���������������Һ��Ϊ ������ĸ����
��ˮ�����ӻ���������������Һ��Ϊ ������ĸ����