题目内容
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是_______________(填实验序号),步骤②中加热所用仪器的名称是___________________;
(2)步骤③中洗涤沉淀的操作是___________________________________。
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
用下图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表: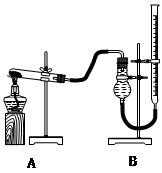
| 实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
| ④ | 1.2 g | 无其他物质 | |
| ⑤ | 1.2 g | CuO 0.5 g | |
| ⑥ | 1.2 g | MnO2 0.5 g | |
(3)上述实验中的“待测数”据指_____________;
(4)本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
(5)若要读取实验⑤中干燥管内收集的气体体积,应注意 ____________________
____________________________________________________;
⑹为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a._______________________________,
b.CuO的化学性质有没有改变
(1)①②③ 蒸发皿 (2)沿玻璃棒向过滤器中的沉淀上加蒸馏水 至淹没沉淀,静置使其全部滤出,重复2~3次 (3)时间 (4)碱式 (5)待装置内的气体冷却至室温后,上下移动滴定管,使两边的液面相平,视线要与凹液面相切。 ⑹CuO的质量有没有改变
解析试题分析:(1)在①溶解物质用玻璃棒搅拌 。②给物质加热用玻璃棒搅拌是水分快速蒸发。③过滤用玻璃棒引流。步骤②中用蒸发皿加热。(2)洗涤沉淀的操作沿玻璃棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2~3次 (3)上述实验中的“待测数”据指生成25 mL气体所需要的时间。(4)酸式滴定管下边有活塞,容易漏液体,所以要用碱式滴定管。(5)为减小实验误差,提高实验的准确度,读取气体体积时应注意待装置内的气体冷却至室温后,上下移动滴定管,使两边的液面相平,视线要与凹液面相切。 催化剂是能改变其它物质的化学反应速率,而本身的质量和化学性质不发生改变的物质。所以还需测CuO的质量有没有改变。
考点:考查玻璃棒的作用、正确量取气体的方法、催化作用的测定的实验知识。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺。己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
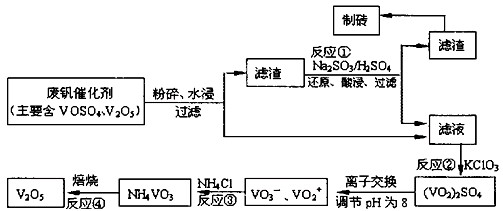
该工艺的主要流程如下:
请回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其反应的化学方程式为 。
(2)反应①的目的是 。
(3)若用NaOH溶液调节pH,则转化②的离子方程式为 。
(4)实验室中实现反应③所需主要仪器除三脚架、泥三角、酒精灯外,必不可少的是 。
(5)V2O5为硫酸工业接触室中的重要催化剂,其催化反应为2SO2(g)+O2(g)
 2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为
2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为 。
。①该条件下反应2SO2(g)+O2(g)
 2SO3(g) 的平衡常数为_____;
2SO3(g) 的平衡常数为_____;②下列措施能使
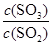 增大的是_____。
增大的是_____。A.升高温度
B.保持温度和容积不变,再充入2 mol He
C.保持温度和容积不变,再充入2 mol SO2和1 mol O2
D.不用V2O5作催化剂,改用其它更高效催化剂
(12分)根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:
2NO+2CO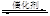 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | | | | | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | | | 80 |
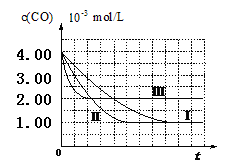
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________
(填“增大”、“减小”、“无影响”);
某同学对MnO2、CuO、Fe2O3、Cr2O3在氯酸钾受热分解反应中的催化作用进行了研究。实验所得数据如下表。就本实验的有关问题,请填空:
| 实验编号 | KClO3(g) | 氧化物 | 产生气体(mL)(已折算为标况) | 耗时(s) | ||
| 化学式 | 质量(g) | 实际回收 | ||||
| 1 | 0.6 | — | — | — | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
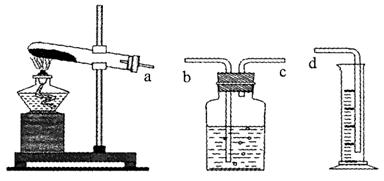
(1)本实验的装置由下图三部分组成,其正确的接口连接顺序为 。
(2)为证明编号2的实验中MnO2起到催化作用,还要测定反应剩余物中MnO2的质量,实验的操作顺序是:溶解→ 。
(3)写出实验室中通过编号2制取氧气的化学方程式:
(4)从上表实验数据分析,对氯酸钾受热分解有催化作用的物质,按其催化能力从大到小的顺序为 (填物质的化学式)。
(5)在进行编号5的实验时,有刺激性的黄绿色气体产生,该气体可能是 (填化学式),可用 试纸检验该气体,上述异常现象产生的原因是 。
某探究小组用测量HNO3与大理石反应过程中因二氧化碳逸出质量减小的方法,研究影响反应速率的因素。限选试剂:(实验过程中不考虑稀硝酸的挥发)
1.0mol·L-1 HNO3、2.0mol·L-1 HNO3、细颗粒大理石、粗颗粒大理石、35 ℃水浴
(1)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol·L-1 |
| ① | 常温 | 粗颗粒大理石 | |
| ② | 常温 | 粗颗粒大理石 | 2.0 |
| ③ | | 粗颗粒大理石 | 2.0 |
| ④ | 常温 | | 2.0 |
以上表格中实验①、③、④空格处应填 、 、 。
(2)整个实验中应控制的不变量是硝酸溶液体积和 。
(3)该实验小组用如图实验装置进行实验。
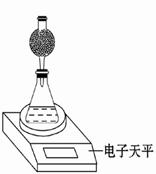
①除电子天平、干燥管、胶头滴管、秒表、玻璃棒、锥形瓶、药匙、胶塞等仪器外,必需的玻璃仪器还有 。
②干燥管中应放置的试剂是 。
A.碱石灰 B.无水CaCl2固体
C.生石灰 D.浓硫酸
③若撤除干燥管装置,所测速率 (填“偏大”、“偏小”或“不变”)。
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生。 |
(1)过氧化氢分解的化学方程式为__________________________________________。
(2)实验①的目的是______________________________________________________。实验中滴加FeCl3溶液的目的是_________________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是__________________________________(用实验中所提供的几种试剂)。
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最慢的是______________________。

下表是稀硫酸与某金属反应的实验数据:
| 实验序号 | 金属质量/g | 金属状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 2 | 0.10 | 块状 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 块状 | 1.0 | 50 | 20 | 35 | 125 |
(1)实验1和3表明, 对反应速率有影响,能表明这种影响因素的实验还有 (填实验序号)。
(2)本实验中影响反应速率的其他因素还有 ,其实验序号是 。该实验说明 ,则反应速率越快;
(3)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:
。
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是
| A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+c (C2O42-) =" 0.1" mol·L-1 |
| C.c(C2O42-) < c(H2C2O4) |
| D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
下列说法正确的是 ( )
| A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| B.因为CH3COOH是弱电解质,HCl是强电解质,所以中和等体积等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比盐酸消耗的NaOH用量少 |
| C.物质的量浓度相同的磷酸钠溶液和磷酸溶液中PO43-的物质的量浓度相同 |
| D.足量Zn分别和等体积、等物质的量浓度的盐酸和醋酸反应时,产生H2的量相同,放出H2的速率不等 |