题目内容
消除汽车尾气是减少城市空气污染的热点研究课题。
(1)汽车内燃机工作时发生的反应N2(g) + O2(g) 2NO(g),生成的NO是汽车尾气的主要污染物。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol(不考虑后续反应)。则:
2NO(g),生成的NO是汽车尾气的主要污染物。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol(不考虑后续反应)。则:
①5 min内该反应的平均速率ν(NO) = ;在T ℃时,该反应的平衡常数K = 。
② 反应开始至达到平衡的过程中,容器中下列各项发生变化的是 (填序号)。
a.混合气体的密度 b.混合气体的压强
c.正反应速率 d.单位时间内,N2和NO的消耗量之比
(2)用H2或CO催化还原NO可以达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) ? △H =" —180.5" kJ·mol-1
2H2O(l) =2H2(g) + O2(g) ?△H =" +571.6" kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是
。
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应2NO(g) + 2CO(g)
 2CO2(g) + N2(g) 中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中,NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
① 该反应的?H 0 (填“>”或“<”)。
②若催化剂的表面积S1>S2 ,在右图中画出c(NO) 在T1、 S2 条件下达到平衡过程中的变化曲线(并作相应标注)。
(16分)
(1)(共9分)① 0.2 mol·L-1·min-1(2分) 1.25(3分) ② c d(4分)
(2)(共3分)2H2(g) + 2NO(g)=N2(g) + 2H2O(l) ?△H = -752.1 kJ·mol-1
(3)(共4分)① <(2分)
②(2分)见图: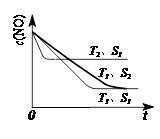
解析试题分析:(1)①由于c=n/V,各组分变化浓度之比等于系数之比,由此推断该反应体系中各组分的(起始、变化、平衡)浓度,则:
N2(g) + O2(g) 2NO(g)
2NO(g)
起始浓度(mol/L) 1.3 1.5 0
变化浓度(mol/L) 0.5 0.5 1
平衡浓度(mol/L) 0.8 1.0 1
根据平均反应速率的定义式,v(NO)=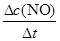 =
=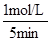 =0.2mol/(L?min)
=0.2mol/(L?min)
根据化学平衡常数的定义式,K=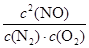 =
=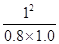 mol2/L2≈1.25
mol2/L2≈1.25
②混合气体的密度等于混合气体总质量除以容器体积,由于该反应各组分都是气体,所以混合气体总质量始终保持不变,容器体积始终为5L,因此混合气体密度始终保持不变,且密度不变不能说明达到平衡,故a错误;由于N2(g)+ O2(g) 2NO(g)的正反应是气体物质的量保持不变的反应,则混合气体总的物质的量始终不变,且容器内混合气体的压强始终不变不能说明达到平衡,故b错误;从反应开始达到平衡,反应物浓度逐渐减小,所以正反应速率逐渐减小,故c正确;单位时间内,N2和NO的消耗量之比就是正反应速率和逆反应速率之比,反应开始时,正反应速率最大、逆反应速率最小,此时N2和NO的消耗量之比最大,反应达到平衡时,正反应速率=逆反应速率,此时N2和NO的消耗量之比最小(为1/2),故d正确;
2NO(g)的正反应是气体物质的量保持不变的反应,则混合气体总的物质的量始终不变,且容器内混合气体的压强始终不变不能说明达到平衡,故b错误;从反应开始达到平衡,反应物浓度逐渐减小,所以正反应速率逐渐减小,故c正确;单位时间内,N2和NO的消耗量之比就是正反应速率和逆反应速率之比,反应开始时,正反应速率最大、逆反应速率最小,此时N2和NO的消耗量之比最大,反应达到平衡时,正反应速率=逆反应速率,此时N2和NO的消耗量之比最小(为1/2),故d正确;
(2)根据盖斯定律,已知的前一个热化学方程式减去后一个热化学方程式,可以得到:2H2(g) + 2NO(g)=N2(g) + 2H2O(l) ?△H = -752.1 kJ·mol-1;(3)读图,两条曲线先后达到平衡,说明T2>T1,即升高温度,平衡时c(NO)增大,由于升温平衡向吸热方向移动,c(NO)增大说明平衡向逆反应方向移动,则逆反应是吸热反应,所以正反应是放热反应,△H<0;画图要点:S1变为S2,即减小催化剂表面积,反应速率减小,单位时间内NO的变化浓度减小,则T1、S2的曲线位于T1、S1曲线的右边;催化剂不能使平衡移动,所以NO的平衡浓度与T1、S1曲线相同,只是达到平衡的时间比T1、S1曲线增大。
考点:考查化学反应原理,涉及求平均反应速率、化学平衡常数、化学平衡的建立、盖斯定律、热化学方程式、放热反应、吸热反应、画催化剂对反应速率和平衡移动的影响曲线。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺。己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
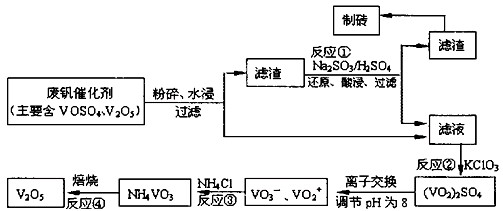
该工艺的主要流程如下:
请回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其反应的化学方程式为 。
(2)反应①的目的是 。
(3)若用NaOH溶液调节pH,则转化②的离子方程式为 。
(4)实验室中实现反应③所需主要仪器除三脚架、泥三角、酒精灯外,必不可少的是 。
(5)V2O5为硫酸工业接触室中的重要催化剂,其催化反应为2SO2(g)+O2(g)
 2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为
2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为 。
。①该条件下反应2SO2(g)+O2(g)
 2SO3(g) 的平衡常数为_____;
2SO3(g) 的平衡常数为_____;②下列措施能使
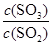 增大的是_____。
增大的是_____。A.升高温度
B.保持温度和容积不变,再充入2 mol He
C.保持温度和容积不变,再充入2 mol SO2和1 mol O2
D.不用V2O5作催化剂,改用其它更高效催化剂
“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
① 实验1条件下平衡常数K= (保留小数点后二位数字)。
② 实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值 (填具体值或取值范围)。
③ 实验4,若900℃时,在此容器中加入10molCO、5molH2O、2molCO2、5molH2,则此时v(正) v(逆)(填“<”、“>”、“=”)。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)已知BaSO4(s) + 4C(s) ="4CO(g)" + BaS(s) △H1 =+571.2kJ/mol,
BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s) △H2="+226.2" kJ/mol。
则反应C(s) + CO2(g) = 2CO(g)的△H3= kJ/mol。
 (4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0)
(4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为: 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 。(Li的相对原子质量约为7.0) (12分)根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:
2NO+2CO 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | | | | | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | | | 80 |
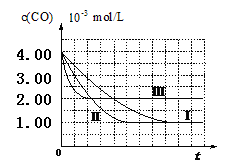
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________
(填“增大”、“减小”、“无影响”);
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 | 金属质量/g | 金属状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 2 | 0.10 | 块状 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 块状 | 1.0 | 50 | 20 | 35 | 125 |
(1)实验1和3表明, 对反应速率有影响,能表明这种影响因素的实验还有 (填实验序号)。
(2)本实验中影响反应速率的其他因素还有 ,其实验序号是 。该实验说明 ,则反应速率越快;
(3)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:
。
 CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
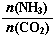 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
 2NH3(g) 在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。试求:(写出解题过程)
2NH3(g) 在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。试求:(写出解题过程)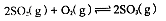 ,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题: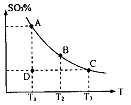
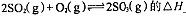 0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度 (填“增大”、“减小”或“不变”)。
0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度 (填“增大”、“减小”或“不变”)。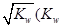 是水的离子积),则这两种溶液可为 (填字母)。
是水的离子积),则这两种溶液可为 (填字母)。