题目内容
【题目】某同学在实验室中发现了一瓶无色、有刺激性气味的气体,根据气味判断可能是氨气,但不能确定一定是氨气。下列提供的方法中,你认为能够帮他检验是否为氨气的是
A. 将湿润的红色石蕊试纸放在打开的瓶口
B. 将湿润的蓝色石蕊试纸放在打开的瓶口
C. 用蘸有浓硫酸的玻璃棒靠近打开的瓶口
D. 用干燥的红色石蕊试纸放在打开的瓶口
【答案】A
【解析】检验气体最好用试纸。氨气与水反应呈碱性,可使湿润的红色石蕊试纸变蓝色。B项蓝色石蕊试纸遇氨气仍为蓝色;C项错误,因浓硫酸不挥发;D项错误,干燥的红色石蕊试纸不与氨气反应。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
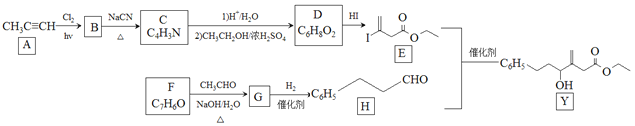
名师点睛字词句段篇系列答案【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H=?
2N2(g) +6H2O(g) △H=?
(1)
化学键 | H—O | O===O | N≡N | N—H |
键能kJ·molˉ1 | a | b | c | d |
△H=__________________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是__________________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内n(NO)/n(NH3)=1时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
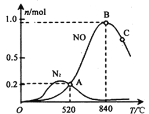
①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
②520℃时,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常数K=___________________ (不要求得出计算结果,只需列出数字计算式)。
4NO(g) +6H2O(g)的平衡常数K=___________________ (不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有_______________
A.使用催化剂Pt/Ru
B.使用催化剂Cu/TiO2
C.增大NH3和O2的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
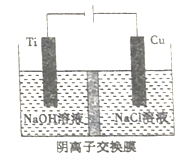
(4)纳米级Cu2O 由于具有优良的催化性能而受到关注,工业上常用电解法Cu2O,其反应为2Cu+H2O![]() Cu2O+H2↑ 采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,则阳极上的电极反应式为___________________,当生成_______克Cu2O时,就会有NA个阴离子通过离子交换膜。
Cu2O+H2↑ 采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,则阳极上的电极反应式为___________________,当生成_______克Cu2O时,就会有NA个阴离子通过离子交换膜。