��Ŀ����
����Ŀ��NH3��Ϊһ����Ҫ����ԭ�ϣ�������Ӧ���ڹ�ҵ�����������й����ʷ�Ӧ�Ĵ����о������������863�ƻ������������н�ǿ��ѡ���ԣ���רһ�ԡ���֪��
��ӦI��4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) ��H=�D905.0 kJ��mol��1
4NO(g) +6H2O(g) ��H=�D905.0 kJ��mol��1
��Ӧ II��4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) ��H=��
2N2(g) +6H2O(g) ��H=��
��1��
��ѧ�� | H��O | O===O | N��N | N��H |
����kJ��mol��1 | a | b | c | d |
��H=__________________ ��
��2���ں��º���װ���г���һ������NH3��O2����ij�����������½��з�ӦI���������й���������ȷ����__________________��
A��ʹ�ô���ʱ���ɽ��÷�Ӧ�Ļ�ܣ��ӿ��䷴Ӧ����
B�������������4v��(NH3)=6v��(H2O)ʱ��˵����Ӧ�Ѵ�ƽ��
C����������n(NO)/n(NH3)=1ʱ��˵����Ӧ�Ѵ�ƽ��
��3����������ʱ�ᷢ����������������ӦI��II��Ϊ����ij�����Ը÷�Ӧ��ѡ���ԣ���1L�ܱ������г���1 mol NH3��2mol O2������й����ʵ�����ϵ����ͼ��
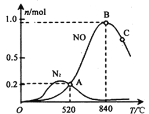
�ٸô����ڸ���ʱѡ��Ӧ____________ (� I ���� II������
��520��ʱ��4NH3(g)+5O2![]() 4NO(g) +6H2O(g)��ƽ�ⳣ��K=___________________ (��Ҫ��ó���������ֻ���г����ּ���ʽ����
4NO(g) +6H2O(g)��ƽ�ⳣ��K=___________________ (��Ҫ��ó���������ֻ���г����ּ���ʽ����
�����������NH3ת��ΪN2ƽ��ת���ʵĴ�ʩ��_______________
A��ʹ�ô���Pt/Ru
B��ʹ�ô���Cu/TiO2
C������NH3��O2�ij�ʼͶ�ϱ�
D��Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ��
E�����ͷ�Ӧ�¶�
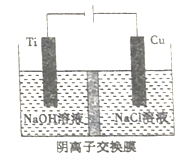
��4������Cu2O ���ھ��������Ĵ����ܶ��ܵ���ע����ҵ�ϳ��õ�ⷨCu2O���䷴ӦΪ2Cu+H2O![]() Cu2O+H2�� �������ӽ���Ĥ���Ƶ��Һ��OH-��Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ���������ϵĵ缫��ӦʽΪ___________________��������_______��Cu2Oʱ���ͻ���NA��������ͨ�����ӽ���Ĥ��
Cu2O+H2�� �������ӽ���Ĥ���Ƶ��Һ��OH-��Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ���������ϵĵ缫��ӦʽΪ___________________��������_______��Cu2Oʱ���ͻ���NA��������ͨ�����ӽ���Ĥ��
���𰸡���H=(12d+3b-2c-12a)kJ��mol��1AI 0��24��0��96/0��44��1.455E2Cu-2e-+2OH-=Cu2O+H2O72
��������
��1����Ӧ���ʱ��H=��Ӧ���ܼ���-�������ܼ��ܡ���2�������ı䷴Ӧ;�������ͷ�Ӧ��ܣ���ͬ���ʱ�ʾ�������淴Ӧ����֮�ȵ��ڻ�ѧ������֮��ʱ����Ӧ�ﵽƽ��״̬������Ӧ�ﵽƽ��״̬ʱ�������淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䡣��3���ٸ��������ﵪ����NO�����ʵ����жϴ����Է�Ӧ��ѡ���ԣ���520��ƽ��ʱn��NO��=n��N2��=0.2mol�����÷���ʽ����������Ӧ���ĵİ������������ʵ����Լ����ɵ�ˮ�����ʵ��������Լ���ƽ��ʱ�������������ʵ����������������Ϊ1L���������ʵ�������Ũ�ȴ���K=c4��NO��c6��H2O��/c4��NH3��c5��O2�����㣻�۴�����Ӱ��ƽ���ƶ����ı�Ũ����Ͷ�ϱȲ�Ӱ������Է�Ӧ��ѡ���ԣ�ͼ���¶�Ӱ�����ѡ���ԡ���4��ͭ�缫�͵�Դ��������������������ʧȥ���ӷ���������Ӧ���缫��Ӧʽ��2Cu��2e����2OH����Cu2O��H2O��
��1����Ӧ���ʱ��H=��Ӧ���ܼ���-�������ܼ���=��4��3��d+3b-2��c-6��2��a��kJ/mol=(12d+3b-2c-12a)kJ��mol��1����2������������ı䷴Ӧ;�������ͷ�Ӧ�Ļ�ܣ������˻���Ӱٷ�������ѧ��Ӧ��������A��ȷ�����ڷ�Ӧ4NH3��g��+5O2��g��?4NO��g��+6H2O��g����Ӧ�� 6v����NH3��=4v����H2O��ʱ����Ӧ�ﵽƽ��״̬��B������Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣬��n��NO��/n��NH3��=1�أ�C����,��ѡA����3������ͼ��֪���ô����ڸ���ʱ�����ɵ�NO���ʵ���Զ���ڵ����ģ��ʸô����ڸ�����ѡ��ӦI������ 1L �ܱ������г��� 1mol NH3�� 2mol O2��520��ƽ��ʱn��NO��=n��N2��=0.2mol����
4NH3��g��+5O2![]() 4NO��g��+6H2O��g��
4NO��g��+6H2O��g��
�仯��mol ����0.2 0.25 0.2 0.3
4NH3��g��+3O2��g��![]() 2N2��g��+6H2O��g��
2N2��g��+6H2O��g��
�仯��mol ����0.4 0.3 0.2 0.6
��ƽ��ʱ��n��NH3��=1mol-0.2mol-0.4mol=0.4mol��n��O2��=2mol-0.25mol-0.3mol=1.45mol��n��H2O��=0.3mol+0.6mol=0.9mol�������������Ϊ1L���������ʵ�������Ũ�ȼ���ƽ�ⳣ��K c4��NO��c6��H2O��/c4��NH3��c5��O2��=0��24��0��96��0��44��1.455����ʹ�ô�����Ӱ��ƽ���ƶ����ӿ췴Ӧ���ʣ����̵���ƽ���ʱ�䣬A����ʹ�ô�����Ӱ��ƽ���ƶ����ӿ췴Ӧ���ʣ����̵���ƽ���ʱ�䣬B��������NH3��O2�ij�ʼͶ�ϱȣ�ƽ�ⳣ�����䣬��Ӱ������Է�Ӧ��ѡ���ԣ�C����Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ�ȣ�ƽ�ⳣ�����䣬��Ӱ������Է�Ӧ��ѡ���ԣ�D������ͼ��֪���������ڵ��������ɣ����ͷ�Ӧ�¶���������� NH3ת��Ϊ N2ƽ��ת���ʣ�E��ȷ����ѡE����4���ڵ����У��������ǻ��õ缫ʱ���õ缫��������ʧ���ӵ�������Ӧ���ڼ��Ի����£�����ͭʧȥ���ӱ���������������ͭ���缫��ӦʽΪ2Cu-2e-+2OH-=Cu2O+H2O�������ĵ缫��ӦʽΪ2H2O+2e��=H2��+2OH-���ɵ缫��Ӧʽ��֪������1molOH-ͨ�������ӽ���Ĥʱ����0.5molCu2O���ɣ�����NA��������ͨ�����ӽ���Ĥʱ������0.5molCu2O���ɣ�0.5molCu2O������Ϊ72g��

 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
