题目内容
【题目】如图是中学化学中常见四种物质在一定条件下的转化关系(其他产物已略去)。根据所学知识,回答下列问题:

(1)若B、X都是气体单质,C遇空气变为红棕色气体,A遇湿润的红色石蕊试纸变蓝,A在纯氧气中点燃可生成单质B,则A是____。写出反应A→C的化学方程式_______
(2)若A是地壳中含量第二位的金属单质,X是一种常见最高价易挥发的含氧酸,常温下,发生如图转化关系,则X是____(填化学名称),B是____,写出反应A→C的离子方程式:______;C→B的离子方程式:_______。
【答案】NH3 4NH3+5O2![]() 4NO+6H2O 硝酸 Fe(NO3)2 Fe+4H++NO
4NO+6H2O 硝酸 Fe(NO3)2 Fe+4H++NO![]() =Fe3++NO↑+2H2O 2Fe3++Fe=3Fe2+
=Fe3++NO↑+2H2O 2Fe3++Fe=3Fe2+
【解析】
(1)C遇空气变为红棕色气体,则C为NO,A遇湿润的红色石蕊试纸变蓝,则A为NH3,A在纯氧气中点燃可生成单质B,B为氮气,反应A→C是氨气催化氧化生成一氧化氮和水,反应的化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)若A是地壳中含量第二位的金属单质,则A为铁;X是一种常见最高价易挥发的含氧酸,常温下,发生如图转化关系,则X是硝酸,B是Fe(NO3)2,C是Fe(NO3)3;反应A→C是铁与足量的稀硝酸反应生成硝酸铁、一氧化氮和水,反应的离子方程式为:Fe+4H++NO![]() =Fe3++NO↑+2H2O;C→B是硝酸铁与铁反应生成硝酸亚铁,反应的离子方程式为:2Fe3++Fe=3Fe2+。
=Fe3++NO↑+2H2O;C→B是硝酸铁与铁反应生成硝酸亚铁,反应的离子方程式为:2Fe3++Fe=3Fe2+。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】实验室以含有Ca2+、Mg2+、Cl-、SO![]() 、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
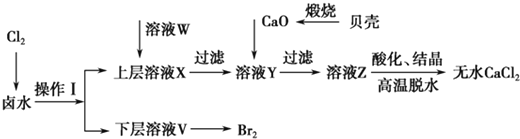
(1)操作Ⅰ使用的试剂是____________,所用主要仪器的名称是________。
(2)加入溶液W的目的是______________。用CaO调节溶液Y的pH,可以除去Mg2+。由表中数据可知,理论上可选择的pH最大范围是____________。酸化溶液Z时,使用的试剂为__________。
开始沉淀时的pH | 沉淀完全时的pH | |
Mg2+ | 9.6 | 11.0 |
Ca2+ | 12.2 | c(OH-)=1.8 mol·L-1 |
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是__________。

(4)常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-8;H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。某同学设计实验验证H2SO3的酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于___________________________。用一个化学方程式表示H2SO3酸性强于H2CO3: __________________。
