题目内容
5.氯气是一种重要的工业原料.工业上利用下列反应来检查氯气管道是否漏气:(1)3Cl2+2NH3═N2+6HCl (2)HCl+NH3═NH4Cl (氯化氢遇氨气产生白烟).下列说法错误的是
( )
| A. | 反应(1)(2)中NH3都显还原性 | B. | 该反应中Cl2显强氧化性 | ||
| C. | 反应(1)属于置换反应 | D. | 生成2mol N2时转移12mol电子 |
分析 3Cl2+2NH3═N2+6HCl中,Cl元素的化合价降低,N元素的化合价升高;HCl+NH3═NH4Cl中没有元素的化合价变化,以此来解答.
解答 解:A.反应(1)中N元素的化合价升高,则氨气具有还原性,而(2)中NH3不显还原性,故A错误;
B.Cl元素的化合价降低,则该反应中Cl2显强氧化性,故B正确;
C.氯气、氮气均为单质,为单质与化合物反应生成新单质、化合物,则反应(1)属于置换反应,故C正确;
D.生成2mol N2时转移2mol×2×[0-(-3)]=12mol电子,故D正确;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
17.下列物质中含氢原子数最多的是( )
| A. | 2mol CH4 | B. | 3mol NH3 | C. | 4mol H3PO4 | D. | 5mol H2 |
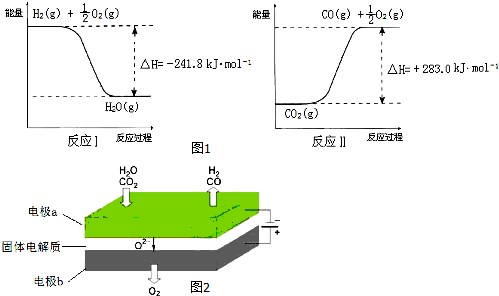

 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: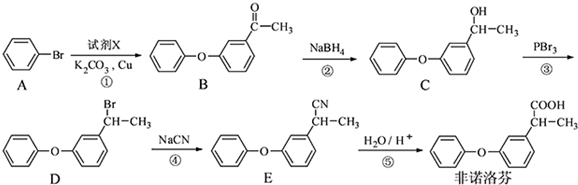
 .
.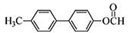 .
.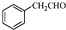 为原料制备
为原料制备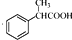 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).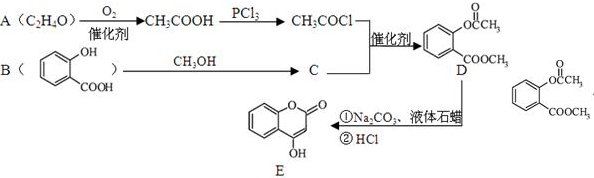
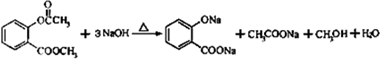 ;写成B与足量NaHCO3溶液完全反应的化学方程式:
;写成B与足量NaHCO3溶液完全反应的化学方程式: .
.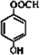 .
.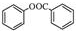 )是一种重要的有机合成中间体.根据图中提示的信息,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
)是一种重要的有机合成中间体.根据图中提示的信息,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).