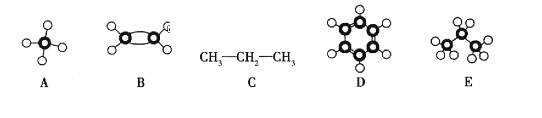
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol—OH(羟基)与l mol![]() 中所含电子数均为10NA
中所含电子数均为10NA
B.常温常压下,水蒸气通过过量的Na2O2使其增重2 g时,反应中转移的电子数为NA
C.0.lmol苯与足量氢气反应后,破坏碳碳双键的数目为0.3NA
D.10g KHCO3和CaCO3的固体混合物中含有的![]() 数目为0.1NA
数目为0.1NA
【答案】B
【解析】
A.羟基不显电性,故1 mol羟基中含(8+1)mol=9 mol电子,即9NA个,A错误;
B.根据2H2O + 2Na2O2=4NaOH + O2↑可知,增重的质量为4H的质量,即2H2O + 2Na2O2=4NaOH + O2↑~增重4H~2e-,由此可知,每增重4g,转移2mol电子,增重2 g,转移电子的物质的量=l mol,即NA,B正确;
C.苯分中不存在碳碳双键,C错误;
D.KHCO3固体中含有K+和![]() ,没有
,没有![]() ,D错误。
,D错误。
答案选B。

【题目】下表是A、B、C、D、E五种有机物的有关信息:
A | B | C | D | E |
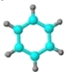
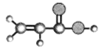
①能使溴的四氯化碳溶液褪色; ②比例模型为: ③能与水在一定条件下反应生成C | ①由C、H两种元素组成; ②球棍模型为: | 分子式为C2H6O,能与E酯化 | ①相对分子质量比C少2; ②能由C氧化而成; | ①由C、H、O三种元素组成; ②球棍模型为: |
根据表中信息回答下列问题:
(1)A到E中,属于烃的是__________(填字母);写出A与溴水反应的化学方程式__________。
(2)B具有的性质是__________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水小 ⑤可使酸性高锰酸钾溶液和溴水均褪色
(3)写出C、D 结构简式:__________、__________。
(4)E 中含氧官能团的名称__________。