题目内容
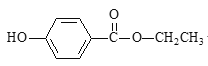
【题目】硝基苯(![]() 可写成C6H5NO2)是一种剧毒化学品,具有致畸、致突变和致癌性。处理含有硝基苯废水的方法有很多,下图是铁、碳微电池法处理含硝基苯废水的工业流程图:
可写成C6H5NO2)是一种剧毒化学品,具有致畸、致突变和致癌性。处理含有硝基苯废水的方法有很多,下图是铁、碳微电池法处理含硝基苯废水的工业流程图:
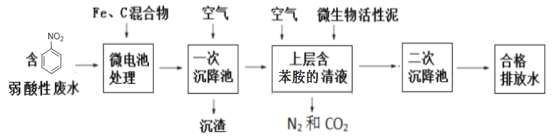
请回答下列问题:
(1)实验室制备硝基苯的化学方程式:_______________________________________;
(2)用分液漏斗分离硝基苯和水的混合物时,硝基苯从_______(填“上”或“下”)口流出。
(3)微电池处理过程中,原电池的负极反应为:Fe-2e-=Fe2+;
①碳表面硝基苯在电极上被还原成苯胺(![]() )的电极反应方程式为:_______________________;
)的电极反应方程式为:_______________________;
②微电池处理过程中部分硝基苯被新生成的活性Fe2+还原成苯胺,该反应的离子反应方程式为:__________________________________________________;
(4)①一次沉降池中通入空气的目的:_____________________________________;
②一次沉降池中适当的升温有利于沉渣的迅速沉降,分析原因:_______________________;(用适当的文字描述和离子方程式解释)
(5)上图中微生物在空气存在的条件下降解苯胺的化学反应方程式为:____________________________。
(6)利用惰性吸附电极电解含硝基苯的废水,同样可以将剧毒的硝基苯转化成苯胺,在电解的过程中,含硝基苯的废水应从_____________极室流入(填:“阳”或“阴”)。
【答案】![]() +HNO3
+HNO3![]()
![]() +H2O 下
+H2O 下 ![]() +6e-+6H+=
+6e-+6H+=![]() +2H2O
+2H2O ![]() +6Fe2++6H+=
+6Fe2++6H+=![]() +6Fe3++2H2O 将Fe2+充分氧化成Fe3+ Fe3+存在水解平衡:Fe3++3H2O
+6Fe3++2H2O 将Fe2+充分氧化成Fe3+ Fe3+存在水解平衡:Fe3++3H2O![]() Fe(OH)3+3H+,升温使水解平衡正向移动,产生更多的Fe(OH)3吸附沉渣 4
Fe(OH)3+3H+,升温使水解平衡正向移动,产生更多的Fe(OH)3吸附沉渣 4![]() +31O2=24CO2+14H2O+2N2 阴
+31O2=24CO2+14H2O+2N2 阴
【解析】
含硝基苯的酸性废水和Fe、C混合发生原电池反应,负极为Fe失电子生成Fe2+,正极为硝基苯得电子还原成苯胺,通过一次沉降将Fe3+、未反应的Fe、C等固体物质除去,上层苯胺在微生物活性泥作用下被空气氧化成二氧化碳和氮气,通过二次沉降将微生物活性泥等固体沉降,此时排放的水已达排放标准。
(1)实验室用苯和浓硫酸、浓硝酸加热到55℃~60℃制备硝基苯,方程式为:![]() +HNO3
+HNO3![]()
![]() +H2O;
+H2O;
(2)硝基苯与水互不相溶,硝基苯的密度比水大,在下层,故硝基苯从分液漏斗下口流出;
(3)①硝基苯在正极得电子,发生还原反应,生成![]() ,硝基苯(
,硝基苯(![]() 可写成C6H5NO2),
可写成C6H5NO2),![]() 转化为
转化为![]() ,脱去2个O,加入2个H,脱去1个O原子,化合价降低2价,加入1个H化合价降低1价,则共降低6价,电极反应为:
,脱去2个O,加入2个H,脱去1个O原子,化合价降低2价,加入1个H化合价降低1价,则共降低6价,电极反应为:![]() +6e-+6H+=
+6e-+6H+=![]() +2H2O;
+2H2O;
②结合①中N元素化合价可写出硝基苯被Fe2+还原成苯胺的离子方程式为:![]() +6Fe2++6H+=
+6Fe2++6H+=![]() +6Fe3++2H2O;
+6Fe3++2H2O;
(4)①通入空气是将溶液中的Fe2+氧化成Fe3+,最后升高温度促进Fe3+水解,使其转化成Fe(OH)3沉淀而除去;
②结合①分析可知,Fe3+存在水解平衡:Fe3++3H2O![]() Fe(OH)3+3H+,升温使水解平衡正向移动,产生更多的Fe(OH)3吸附沉渣,故升温有利于沉渣的迅速沉降;
Fe(OH)3+3H+,升温使水解平衡正向移动,产生更多的Fe(OH)3吸附沉渣,故升温有利于沉渣的迅速沉降;
(5)在微生物存在下,苯胺被氧气氧化成二氧化碳和氮气,结合原子守恒、电子得失守恒可写出方程式为:4![]() +31O2=24CO2+14H2O+2N2;
+31O2=24CO2+14H2O+2N2;
(6)硝基苯得电子转化成苯胺,阴极得电子,应将硝基苯的废水应从阴极室流入。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】下列实验可以达到目的或得出结论的是( )
选项 | 实验目的或结论 | 实验过程 |
A | 探究浓硫酸的脱水性 | 向表面皿中加入少量胆矾,再加入约3mL浓硫酸,搅拌,观察实验现象 |
B | 相同温度下,Ksp(ZnS)<Ksp(CuS) | 向2mL ZnSO4 和CuSO4的混合溶液中逐滴加入0.01mol/L Na2S溶液,先出现白色沉淀 |
C | 淀粉已经完全水解 | 取少量酸催化后的淀粉水解液于试管中,先加入过量氢氧化钠溶液中和酸,再加少量碘水,溶液未变蓝 |
D |
| 向NaAlO2的试管中滴加碳酸氢钠溶液,产生白色沉淀 |
A.AB.BC.CD.D