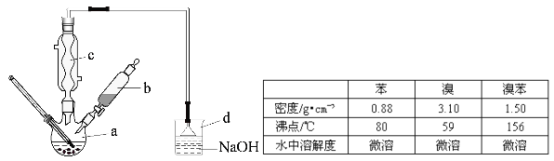
题目内容
【题目】SAH(NaAlH4)还原性非常强。纯的四氢铝钠是白色晶状固体,在干燥空气中相对稳定,但遇水即爆炸性分解,NaH遇水蒸气也发生剧烈反应。以铝合金废边脚料为原料(主要成分为Al,含有少量Al2O3、Fe2O3、MgO、PbO和SiO2等杂质)制备四氢铝钠:
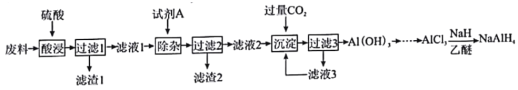
请回答下列问题:
(1)滤渣1的主要成分为____________(填化学式)。试剂A中溶质的阴、阳离子所含电子数相等,其电子式为____________。
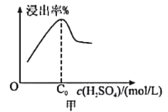
(2)已知废料接触面积、接触时间均相同,“酸浸”中铝元素浸出率与硫酸浓度的关系如图甲所示。当硫酸浓度大于C0mol/L时,浸出率降低的原因可能是__________________。
(3)滤液3可以循环利用,写出滤液2与滤液3反应的离子方程式__________________。
(4)NaAlH4与水反应的化学方程式为__________________。
(5)测定NaAlH4粗产品的纯度。
称取mgNaAlH4粗产品按如图乙所示装置进行实验,测定产品的纯度。
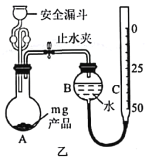
①“安全漏斗”中“安全”的含义是__________________。
②已知实验前C管读数为V1mL,向A中加入适量蒸馏水使NaAlH4完全反应,当A中反应完全后,冷却至室温后C管读数为V2mL(均折合成标准状况)。则该产品的纯度为_____________(用含m、V1和V1的代数式表示,忽略加入蒸馏水的体积)。
③若实验前读数时B管和C管液面相平,实验后读数时B管液面高于C管,则测得的结果_____________(填“偏高”“偏低”或“无影响”)。
【答案】SiO2、PbSO4 ![]() 硫酸浓度增大,铝片与硫酸发生钝化
硫酸浓度增大,铝片与硫酸发生钝化 ![]()
![]() 加入液体能起液封作用,避免气体从漏斗中逸出
加入液体能起液封作用,避免气体从漏斗中逸出 ![]() 偏高
偏高
【解析】
用硫酸酸浸废料(主要成分为Al,含有少量Al2O3、Fe2O3、MgO、PbO和SiO2等杂质),PbO与硫酸反应生成的PbSO4为沉淀,不溶于水,SiO2不溶,过滤,滤渣1为SiO2和PbSO4,滤液1含有Al3+、Fe3+、Mg2+,加入试剂A同时除去杂质离子Fe3+、Mg2+,并将Al3+转化为AlO2-,则试剂A为强碱,且应足量,滤渣2为Fe(OH)3、Mg(OH)2,滤液2含有AlO2-,通入过量的CO2,发生反应:AlO2- + CO2+2H2O=Al(OH)3↓+HCO3-,过滤得到Al(OH)3,滤液3含有HCO3-,将Al(OH)3转化为AlCl3,再进一步与NaH反应得到NaAlH4,据此分析作答。
(1)用硫酸酸浸废料时,PbO与硫酸反应生成的PbSO4为沉淀,不溶于水,SiO2与硫酸不反应,则滤渣1的主要成分为SiO2、PbSO4,试剂A为强碱,且试剂A中溶质的阴、阳离子所含电子数相等,则A为NaOH,其电子式为![]() ,故答案为:SiO2、PbSO4;
,故答案为:SiO2、PbSO4;![]() ;
;
(2)硫酸浓度增大,铝片与浓硫酸发生钝化,故当硫酸浓度大于C0mol/L时,铝元素浸出率降低,故答案为:硫酸浓度增大,铝片与硫酸发生钝化;
(3)滤液2含有AlO2,滤液3含有HCO3,AlO2与HCO3发生反应生成氢氧化铝沉淀和碳酸根离子,该反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)NaAlH4与水反应生成偏铝酸钠和氢气,故该反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)①反应中生成气体,安全漏斗加入液体能起液封作用,避免气体从漏斗中逸出,故答案为:加入液体能起液封作用,避免气体从漏斗中逸出;
②生成的氢气体积为(V1V2)mL,根据反应![]() ,可得关系式,
,可得关系式,![]() ,故该产品的纯度为
,故该产品的纯度为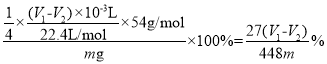 ,故答案为:
,故答案为:![]() ;
;
③读取气体体积前,使左右两管内液面相平,而且视线要平视,若反应结束后,读数时B管液面高于C管,存在液压差,导致测得的氢气体积偏大,测定结果偏高,故答案为:偏高。

 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】党的十九大报告中多次提及“绿色环保”“生态文明”,而CO2的有效利用可以缓解温室效应,解决能源短缺问题。中科院大连化学物理研究所的科研人员在新型纳米催化剂Na—Fe3O4和HMCM—22的表面将CO2转化为烷烃,其过程如图。

上图中CO2转化为CO的反应为:CO2(g)+H2(g)=CO(g)+H2O(g) △H =+41kJ/mol
已知:2CO2(g)+6H2(g)= C2H4(g)+ 4H2O(g) △H =-128kJ/mol
(1)图中CO转化为C2H4的热化学方程式是______________________。
(2)Fe3O4是水煤气变换反应的常用催化剂,可经CO、H2还原Fe2O3制得。两次实验结果如表所示:
实验I | 实验II | |
通入气体 | CO、H2 | CO、H2、H2O(g) |
固体产物 | Fe3O4、Fe | Fe3O4 |
结合化学方程式解释H2O(g)的作用______________________。
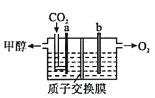
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如图所示,电极a接电源的____________极(填“正”或“负”),生成甲醇的电极反应式是______________________。
(4)用CO、H2生成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
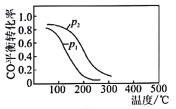
①△H2______________(填“>”“<”“=”)0。
②写出两条可同时提高反应速率和CO转化率的措施______________________________________。
③下列说法正确的是___________(填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充人稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④0~3min内用CH3OH表示的反应速率v(CH3OH)=____________mol·L-1·min-1
⑤200℃时,该反应的平衡常数K=_____________。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变则化学平衡__________(填“正向”“逆向”或“不”)移动。