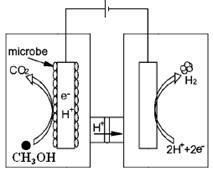
题目内容
:如图所示,在一定温度下,把2体积N2和6体积H2通入一个带有活塞的容积可变的容器中,活塞的一端与大气相通,容器中发生以下反应: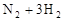

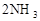 (正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题:
(正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题: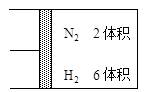
(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各气体的体积分数仍与上述平衡相同,那么:
①若a=1,c=2,则b=_________。在此情况下,反应起始时将向_________(填“正”或“逆”)反应方向进行。
②若需规定起始时反应向逆反应方向进行,则c的取值范围是_________。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是_________,原因是_________。
(1)①b=3 逆 ② (2)降温 由6.5<7可知,上述平衡应向体积缩小的方向移动,亦即向放热方向移动
(2)降温 由6.5<7可知,上述平衡应向体积缩小的方向移动,亦即向放热方向移动
解析

相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | | |
| | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ
(7分)
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有 和 。
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 体积/mL | 50 | 120 | 232 | 290 | 310 |
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为________。
③试分析1~3min时间段里,反应速率变大的主要原因 。
(3)对于容积固定的反应:N2(g)+3H2(g)
 2NH3(g)(正反应放热),达到平衡的标志有___ 。
2NH3(g)(正反应放热),达到平衡的标志有___ 。A N2、H2、NH3的百分含量不再变化 B 总压强不变
C N2、H2、NH3的分子数之比为1∶3∶2 D N2、H2、NH3的浓度相等
E.N2、H2不再起反应 F.v(N2)=v(H2)
G.混合气体的密度不变 H.混合气体的平均相对分子质量不变
I.正反应放出的热量等于逆反应吸收的热量
(14分)我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化
步骤及生成物未列出):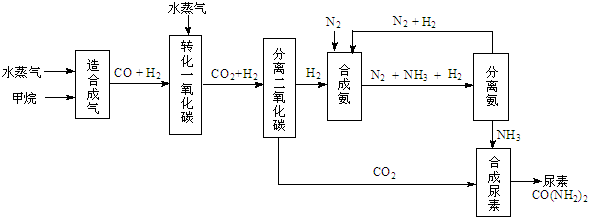
(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)  CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
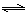 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:提高氢碳比[ n(H2O)/n(CO)],K值 (填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1∶3,此时v(正) v(逆)(填“>”、“=”或“<”)。
(3)有关合成氨工业的说法中正确的是 。
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3)∶n(CO2)的最佳配比为 ,而实际生产过程中,往往使n(NH3)∶n(CO2)≥3,这是因为 。
(5)当甲烷合成氨气的转化率为60%时,以3.0×108 L甲烷为原料能够合成 L 氨气。(假设体积均在标准状况下测定)
(16分)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
____C+____K2Cr2O7 + ====___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O
请完成并配平上述化学方程式。
其中氧化剂是________________,氧化产物是_________________
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1
①已知: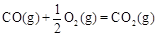 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1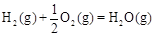 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程为 ;
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答: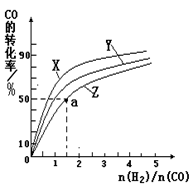
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) CH3OH(g)的平衡常数K= 。
CH3OH(g)的平衡常数K= 。
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol?L-1)变化如下表所示:
| | 0min | 5min | 10min |
| CO | 0.1 | | 0.05 |
| H2 | 0.2 | | 0.2 |
| CH3OH | 0 | 0.04 | 0.05 |
(16分)影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响反应速率的因素。甲同学的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
| ②____________ | | 反应物浓度越大,反应速率越快 |
(2)甲同学的实验目的是_____________;要得出正确的实验结论,还需控制的实验条件是____________。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。
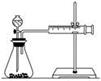
(3)乙同学在实验中应该测定的数据是___________________________________________________。
(4)乙同学完成该实验应选用的实验药品是________,该实验中不选用某浓度的硫酸,理由是___________。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________(填字母)。
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
 2C(g) ,在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度)。试回答下列问题:
2C(g) ,在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度)。试回答下列问题: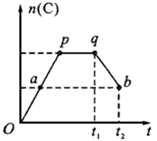
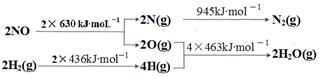
 CH4 (g)+2H2O(g)
CH4 (g)+2H2O(g)