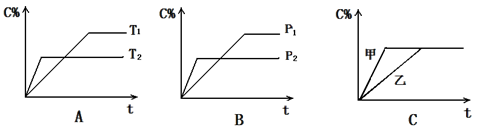题目内容
(16分)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
____C+____K2Cr2O7 + ====___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O
请完成并配平上述化学方程式。
其中氧化剂是________________,氧化产物是_________________
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1
①已知: △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1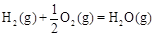 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程为 ;
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答: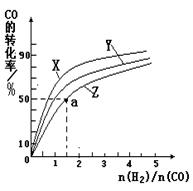
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) CH3OH(g)的平衡常数K= 。
CH3OH(g)的平衡常数K= 。
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol?L-1)变化如下表所示:
| | 0min | 5min | 10min |
| CO | 0.1 | | 0.05 |
| H2 | 0.2 | | 0.2 |
| CH3OH | 0 | 0.04 | 0.05 |
(1)3 2 8 H2SO4 3 2 2 8 (3分,填上H2SO41分,配平2分)
K2Cr2O7(1分),CO2(1分)
(2)①CH3OH(g)+3/2O2(g)= CO2(g)+ 2H2O(g) △H=-651kJ·mol-1(3分)
②ⅰ)270℃(2分) ⅱ) 4 L2 /mol2(2分,没单位不扣分)
③增大H2的浓度(2分);增大了0.1 mol?L-1(2分)
解析试题分析:
(1)从____C+____K2Cr2O7 + ==___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O式用原子守恒法分析,所缺的物质当属H2SO4,先标出变价元素的化合价,利用电子得失相等进行配平,最后利用原子守恒将其它物质配平即可;在有元素化合价下降的反应物都为氧化剂,含有化合价升高的元素的生成物都是氧化产物,从化合价角度判断。
(2)①先写出甲醇燃烧的方程式,标明各物质的状态,利用盖斯定律求得焓变。
ⅰ)根据甲醇的合成方程式,其为放热反应,所以温度高不利于一氧化碳的转化,转化率低的温度较高,所以Z线为270℃
ⅱ) 由坐标中读出CO的转化率为50%,n(H2)/n(CO)=1.5,可设n(CO)=amol,则n(H2)=1.5amol
依题意得,体积为1L CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)
起始: a mol/L 1.5a mol/L 0
变化: 0.5 mol/L a mol/L 0.5 mol/L
平衡: 0.5 mol/L 0.5 mol/L 0.5 mol/L
K= c(CH3OH)/c(CO)·c2(H2)=" 0.5" mol/L÷0.5 mol/L÷(0.5mol/L)2=4L2/mol2
③由题意中提示“只改变了一个条件”,结合起始量和10min时达到平衡的各物质的量,可知,H2的物质的量还是0.2mol ,可知改变的量当为增加了H2的物质的量,而增加了多少则要从10min时的恢复至起始状态
依题意得 CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)
起始: 0.1 mol/L 0.3 mol/L 0
变化:
平衡: 0.05 mol/L 0.2mol/L 0.05 mol/L
则起始的氢气浓度当为 0.3 mol/L,对比之前的浓度,所以增加的氢气的量为0.1 mol?L-1
考点:氧化还原反应配平,热化学反应方程式的书写,化学平衡常数计算。

在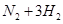

 的可逆反应中,自反应开始至2 s末,氨的浓度由0变为0.4
的可逆反应中,自反应开始至2 s末,氨的浓度由0变为0.4 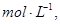 则以氢气的浓度变化表示该反应在2 s内的平均反应速率是
则以氢气的浓度变化表示该反应在2 s内的平均反应速率是
A.0.3 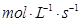 | B.0.4 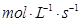 |
C.0.6 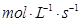 | D.0.8 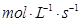 |
(14分)
含硫化合物在工业生产中有广泛的用途。
(1)对于可逆反应2SO2(g)+O2(g) 2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是
(填序号)
| 序号 | A | B | C | D |
| 目的 | 压强对平衡的影响 | 温度对转化率的影响 | 增加O2浓度对速率的影响 | 浓度对平衡常数的影响 |
| 图示 |  |  | 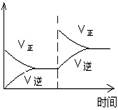 | 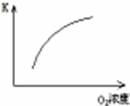 |
乙。(填“>”“<”或“="”" )
(3)向2L的甲容器中充入2molSO2、1molO2,测得SO2的平衡转化率与温度的关系如下图所示。
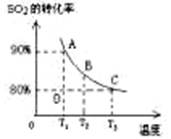
Ⅰ.在T1温度下,反应进行到状态D时,v正 v逆。(填“>”“<”或“="”" )
Ⅱ.T3温度下,平衡时测得反应放出的热量为Q1,在相同温度下若再向容器中通入2molSO2、1molO2,重新达到平衡,测得反应又放出热量Q2 。则下列说法中正确的是 。(填序号)
A.相同温度下新平衡时容器中的压强是原平衡时的两倍
B.Q2一定大于Q1
C.新平衡时SO2的转化率一定大于80%
(4)在甲容器中充入一定量的SO2和1.100molO2,在催化剂作用下加热,当气体的物质的量减少0.315mol时反应达到平衡,此时测得气体压强为反应前的82.5%,则SO2的转化率为 。
(5)若用氢氧化钠溶液吸收SO2气体恰好得到酸式盐,已知该酸式盐溶液呈弱酸性,则溶液中各离子浓度由大到小的顺序为 。(用离子浓度符号表示)
(6)一定温度下,用水吸收SO2气体,若得到pH=5的H2SO3溶液,则溶液中亚硫酸氢根离子和亚硫酸根离子的物质的量浓度之比为 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2mol/L,Ka2=6.0×10-3mol/L)
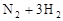

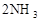 (正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题:
(正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题: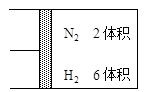
 (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
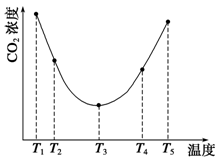

 NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
NaNO3(s)+ClNO(g) K1 ?H < 0 (I)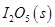 可用于检测CO,反应原理为:
可用于检测CO,反应原理为: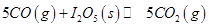
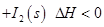 。向2L密闭容器中加入足量
。向2L密闭容器中加入足量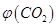 随时间的变化如下图所示。
随时间的变化如下图所示。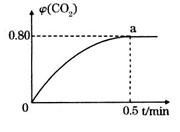
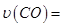 _____________。
_____________。 的体积分数
的体积分数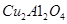 为催化剂,可以将
为催化剂,可以将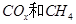 的混合气体直接转化为乙酸。
的混合气体直接转化为乙酸。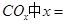 ______________。
______________。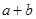 ________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。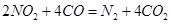 可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。 cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。
cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。