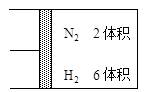��Ŀ����
(14��)�ҹ��зḻ����Ȼ����Դ������Ȼ��Ϊԭ�Ϻϳ����ص���Ҫ��������ͼ��ʾ��ͼ��ijЩת��
���輰������δ�г�����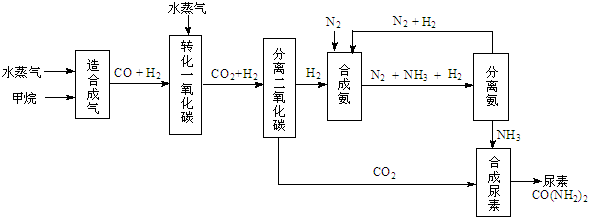
��1������ϳ������������Ȼ�ѧ����ʽ��CH4(g)+H2O(g)  CO(g)+3H2(g)����H��0
CO(g)+3H2(g)����H��0
�ں��º��ݵ������£������CH4�ķ�Ӧ���ʺ�ת���ʣ����д�ʩ���е��� ��
A������ѹǿ B�������¶� C������He�� D������ˮ����Ũ��
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
 H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�
H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£������̼��[ n��H2O��/n��CO��]��Kֵ ������������䡱��С���������÷�Ӧ��400��ʱ���У���ʼͨ������ʵ�����H2O��CO����Ӧ���е�ijһʱ��ʱCO��CO2��Ũ�ȱ�Ϊ1��3����ʱv������ v���棩�����������������������
��3���йغϳɰ���ҵ��˵������ȷ���� ��
A���÷�Ӧ�����˹��̵�
B���ϳɰ���ҵ��ʹ�ô�������߷�Ӧ���������
C���ϳɰ���Ӧ�¶ȿ�����500�����ң�Ŀ����ʹ��ѧƽ��������Ӧ�����ƶ�
D���ϳɰ���ҵ����ѭ����������Ҫԭ����Ϊ�˼ӿ췴Ӧ����
��4���������ع����У�������n(NH3)��n(CO2)��������Ϊ ����ʵ�����������У�����ʹn(NH3)��n(CO2)��3��������Ϊ ��
��5��������ϳɰ�����ת����Ϊ60��ʱ����3.0��108 L����Ϊԭ���ܹ��ϳ� L ������������������ڱ�״���²ⶨ��
��16�֣���ÿ��2�֣���1��B D ��ѡ��1����1�֣�ֻҪѡ����0�֣�
��2�����䣻�� ��3��A��4��2:1�����������CO2��ת���ʣ���ΪNH3��������ˮ�����ڷ��롢�������ã�5��4.8��108
���������������1��A������ѹǿ����Ӧ���ʼӿ죬ƽ�����淴Ӧ�����ƶ��������ת���ʽ��ͣ���A����B�������¶ȣ���Ӧ���ʼӿ죬ƽ��������Ӧ�����ƶ��������ת��������B��ȷ��C������He������Ӧ������Ũ�Ȳ��䣬��Ӧ���ʲ��䣬ƽ�ⲻ�ƶ��������ת���ʲ��䣬��C����D������ˮ����Ũ�ȣ���Ӧ���ʼӿ죬ƽ�����淴Ӧ�����ƶ��������ת��������D��ȷ����ѡBD����2��ƽ�ⳣ��ֻ���¶�Ӱ�죬�뷴Ӧ���Ũ���أ������̼��[n��H2O��/n��CO��]��Kֵ���䣻�ʼH2O��CO�����ʵ�������1mol��ijһʱ��ʱCO��CO2��Ũ�ȱ�Ϊ1:3�����ʱ�μӷ�ӦCOΪxmol����1-x����x=1��3�����x=0.75����
H2O��g��+CO��g��?H2��g��+CO2��g����
��ʼ��mol����1 1 0 0
�仯��mol����0.75 0.75 0.75 0.75
ijʱ�̣�mol����0.25 0.25 0.75 0.75
�ʲ���Ũ����Qc=0.75��0.75�£�0.25��0.25��=9��9.94����Ӧ������Ӧ���У���v��������v���棩����3��A���̵�ָ������̬�ĵ�ת��Ϊ����̬�ĵ����ϳɰ������˹��̵�����A��ȷ��B�������ӿ췴Ӧ���ʣ�����Ӱ��ƽ���ƶ���������߷�Ӧ��������ʣ���B����C���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�����²����ð����ĺϳɣ��ϳɰ���Ӧ�¶ȿ�����500�����ң��ڸ��¶��·�Ӧ���ʽϿ졢�������Խϸߣ���C����D���ϳɰ���ҵ����ѭ��������Ŀ�������ԭ�ϵ������ʣ���D����ѡA����4���������صĻ�ѧʽCO��NH2��2��C��Nԭ����ȫ���������C��Nԭ���غ��֪�������ع����У�������n��NH3����n��CO2����������Ϊ2��1������ʹn��NH3����n��CO2����3���������ڣ����������CO2��ת���ʣ���NH3��������ˮ�����ڷ��롢�������ã���5����CH4��g��+H2O��g��?CO��g��+3H2��g����N2��g��+3H2��g��?2NH3��g�����ɵ�CH4��g����3H2��g����2NH3��g�������ܹ��ϳɰ��������ΪVL����
�ϳ����ķ�Ӧ�У�CH4������������CO����������������3H2��
3.0��108L��60% 3.0��108L��60% 3.0��108L��60%��3
���������̼�������ɵ�H2�����CO��������������������H2��
3.0��108L��60% 3.0��108L��60%
���Բ����������������Ϊ3.0��108L��60%��3+3.0��108L��60%=12��108L��60%
��������������ΪV���� 3H2������������������2NH3
3 2
12��108L��60% V
��V=12��108L��60%�� =4.8��108L
=4.8��108L
���㣺Ӱ�컯ѧƽ������ء���ѧƽ����йؼ��㡢���ݻ�ѧ����ʽ�ļ����֪ʶ��

 ��У����ϵ�д�
��У����ϵ�д����й����жϹ��̵ķ����˵����ȷ���� �� ��
| A�������Է����еĻ�ѧ��Ӧ���Ƿ��ȷ�Ӧ |
| B�����¸�ѹ�¿���ʹʯīת��Ϊ���ʯ���Է��Ļ�ѧ��Ӧ |
| C���������оݺ����о���϶��ɵĸ����оݣ������ʺ������еĹ��� |
| D��ͬһ���ʵĹ̡�Һ��������״̬����ֵ��ͬ |
��16�֣�I����һ����NO2��N2O4�Ļ������ͨ�����Ϊ1L�ĺ����ܱ������У�������Ũ����ʱ��仯�Ĺ�ϵ��ͼ1��ʾ��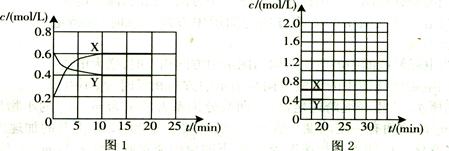
��ش�
��1������ѡ���в���˵���÷�Ӧ�Ѵﵽƽ��״̬���� (��ѡ����ĸ)��
| A�������ڻ�������ѹǿ����ʱ��仯���ı� |
| B�������ڻ��������ܶȲ���ʱ��仯���ı� |
| C�������ڻ���������ɫ����ʱ��仯���ı� |
| D�������ڻ�������ƽ����Է�����������ʱ��仯���ı� |
��
��3������÷�Ӧ��ƽ�ⳣ��K= ��
��4����Ӧ���е�20 minʱ�����������ڳ���һ����NO2��10min��ﵽ�µ�ƽ�⣬��
ʱ���c(NO2)="0.9" mol��L��
��һ��ƽ��ʱ���������NO2���������Ϊw1���ﵽ��ƽ�����������NO2���������Ϊw2����w1 w2 (�>������=����<��)��
����ͼ2�л���20 min������ʵ�Ũ����ʱ��仯������(�����ϱ�������X����
��Y��)��
II����1����ˮ���Ԫ�ش����dz��ḻ���Ӻ�ˮ����ȡ﮵��о�����DZ����������컯ѧ
��Դ����Ҫԭ�ϡ���LiFePO4�����ij�缫�Ĺ���ԭ������ͼ��ʾ��
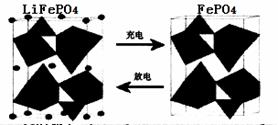
�õ�صĵ����Ϊ�ܴ���Li+�Ĺ�����ϡ��ŵ�ʱ�õ缫�ǵ�ص� ������������������õ缫��ӦʽΪ ��
��2���ô˵�ص�⺬��0.1 mol/L CuSO4��0.1 mol/L NaCl�Ļ����Һ100 mL�������·��ת����0.02 mol e�����ҵ��صĵ缫��Ϊ���Ե缫�����������������ڱ�״���µ������__________L.
ijͬѧ����ϡ������п��ȡ������ʵ���У����ּ�����������ͭ��Һ�ɼӿ��������������ʡ���ش��������⣺
��1������ͭ��Һ���Լӿ������������ʵ�ԭ����________________
��2��ʵ����������Na2SO4��CuCl2��MgSO4��K2SO4��4����Һ����������ʵ����CuSO4
��Һ���������õ���________��
��3��Ҫ�ӿ�����ʵ����������������ʣ����ɲ�ȡ�Ĵ�ʩ��________________(������)
��4��Ϊ�˽�һ���о�����ͭ�����������������ʵ�Ӱ�죬��ͬѧ���������һϵ��ʵ�顣�����������Ļ����Һ�ֱ���뵽6��ʢ�й���Zn���ķ�Ӧƿ�У�
�ռ����������壬��¼�����ͬ�������������ʱ�䡣
| ʵ�� �����Һ | A | B | C | D | E | F |
| 4mol/L H2SO 4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| ����CuSO4��Һ /mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O /mL | V7 | V8 | V9 | V10 | 10 | 0 |
�� ��ͬѧ���ó��Ľ���Ϊ������������CuSO4��Һʱ���������������ʻ�����ߡ����������CuSO4��Һ����һ����ʱ���������������ʷ������½���������������������½�����Ҫԭ��
(8��) CO2������Ҫ��������,��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�����ش����塣
��1����ѧ����H2��CO2�����״�ȼ�ϡ�Ϊ̽���÷�Ӧԭ������������ʵ�飺ij�¶��£����ݻ�Ϊ2 L���ܱ������г���1 mol CO2��3��25 mol H2����һ�������·�Ӧ�����CO2��CH3OH(g)��H2O(g)�����ʵ���(n)��ʱ��ı仯��ϵ��ͼ��ʾ��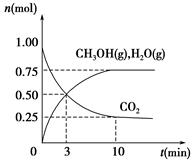
��д���÷�Ӧ�Ļ�ѧ����ʽ_______________________ ����ӷ�Ӧ��ʼ��3 minʱ��������ƽ����Ӧ����v(H2)��____________________��
�����д�ʩ��һ����ʹCO2��ת�����������___________________ ��
A ��ԭ�������ٳ���1 mol H2 B ��ԭ�������ٳ���1 mol CO2
C ��С�������ݻ� D ʹ�ø���Ч�Ĵ���
E����ԭ�����г���1 mol He F����ˮ��������ϵ�з����
��2����ѧ�һ�����������һ���������������̼��Ӧ�����Ҵ�ȼ�ϣ����Ȼ�ѧ��Ӧ����ʽΪ:2CO2(g)��6H2(g)  CH3CH2OH(g)��3H2O(g)����H��a kJ��mol��1��
CH3CH2OH(g)��3H2O(g)����H��a kJ��mol��1��
��3����һ��ѹǿ�£���ø÷�Ӧ��ʵ�����������ʾ������ݱ������ݻش��������⡣
 �¶�(K) �¶�(K) CO2ת����/(%) CO2ת����/(%)n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1��5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
�ں����£���Ӧ��ϵ�м�������������÷�Ӧ�ķ�Ӧ��aֵ________(���������С�����䡱)��
����һ���¶��£�����
 ��ֵ��CO2ת����_________�������Ҵ������ʵ���________(���������С���������䡱����ȷ����)��
��ֵ��CO2ת����_________�������Ҵ������ʵ���________(���������С���������䡱����ȷ����)�� ���������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2���������ձ�����ӡ�
��1��Ŀǰ��ҵ����һ�ַ�������CO2�������״���CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
��ͼ��ʾ�÷�Ӧ���й�������������λΪkJ��mol-1���ı仯���÷�Ӧ�� ������ȡ����ȡ�����Ӧ��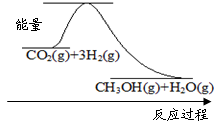
��2��ij�¶��£�����6mol CO2��8 mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����������ͼʵ����ʾ��ͼ����ĸ������ֱ�ʾ��Ӧ�����꣩��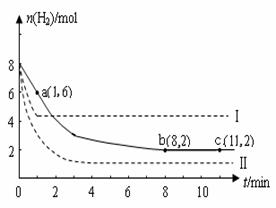
���ڷ�Ӧ���е�0��1min�ڣ��÷�Ӧ��ƽ������v(H2)�� ��
������ı�Ӱ�컯ѧƽ���һ�����أ��磺�¶ȡ�Ũ�ȡ�ѹǿ������Ӧ�������ܹ��������ָı�ķ�����У�������H2��Ũ�ȣ���Ӧ���ҽ����Լ��������������H2��Ũ�ȵ�Ӱ�죩ֱ���ﵽ�µ�ƽ�⡣��������Ӧ��ϵ���ı䷴Ӧ������ʵ��������ֱ�ı�ijһʵ�������ٽ�������ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ������I�ı��ʵ�������� �����ߢ�ı��ʵ�������� ��
��3�����и����У����ܹ�˵��CO2(g)+3H2(g)  CH3OH(g)+H2O(g)�Ѵﵽƽ����� ����ѡ����
CH3OH(g)+H2O(g)�Ѵﵽƽ����� ����ѡ����
| A�����¡����������£������ڵ�ѹǿ�������仯 |
| B��һ�������£�CH3OH���ĵ����ʺ�CH3OH���ɵ�������� |
| C��һ�������£�H2O(g)��Ũ�ȱ��ֲ��� |
| D��һ�������£���λʱ��������1 mol CO2��ͬʱ����1 mol CH3OH |
��12�֣������ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2����ѧ����ʽ���£�
2NO��2CO 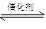 2CO2��N2
2CO2��N2
Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�����±���
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/ mol��L-1 | 1.00��10-3 | 4.50��10-4 | 2.50��10-4 | 1.50��10-4 | 1.00��10-4 | 1.00��10-4 |
| c(CO)/ mol��L-1 | 3.60��10-3 | 3.05��10-3 | 2.85��10-3 | 2.75��10-3 | 2.70��10-3 | 2.70��10-3 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽK= ��
��2��ǰ2s�ڵ�ƽ����Ӧ����v(N2)=_____________��
��3�������������·�Ӧ�ܹ��Է����У���Ӧ��
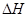 0�����>������<������=������
0����д��>������<������=��������4���������ܱ������з���������Ӧ���ﵽƽ��ʱ���д�ʩ�����NOת���ʵ��� ��
A.ѡ�ø���Ч�Ĵ��� B.���߷�Ӧ��ϵ���¶�
C�����ͷ�Ӧ��ϵ���¶� D.��С���������
��5���о���������ʹ�õ���������ʱ����������ȱ���������ѧ��Ӧ���ʡ�Ϊ�˷ֱ���֤�¶ȡ������ȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��У����ڱ���������ʣ���ʵ����
�����ݡ�
| ʵ���� | T/�� | NO��ʼŨ�� mol��L-1 | CO��ʼŨ�� mol��L-1 | �����ıȱ���� �O��g-1 |
| �� | 280 | 1.2��10-3 | 5.8��10-3 | 82 |
| �� | | | 5.8��10-3 | 124 |
| �� | 350 | 1.2��10-3 | | |

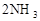 ������Ӧ���ȣ�������Ӧ�ﵽƽ���û����������Ϊ7������ݴ˻ش��������⣺
������Ӧ���ȣ�������Ӧ�ﵽƽ���û����������Ϊ7������ݴ˻ش��������⣺