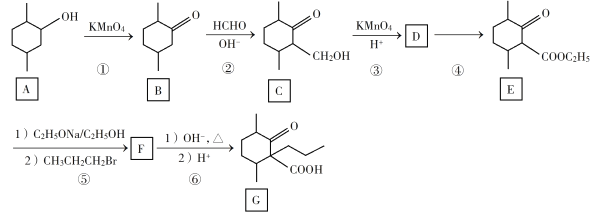
题目内容
【题目】在一定温度下,将气体 X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g) ![]() 2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是
2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是

A.反应前2min的平均速率v(Z)<2.0×103mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C.保持其他条件不变,起始时向容器中充入0.32mol气体X和0.32mol气体Y,到达平衡时,c(Z)>0.24mol·L-1
D.该温度下此反应的平衡常数:K=1.44
【答案】D
【解析】
A.反应前 2 min 内Y的改变量为0.04mol,则Z改变量为0.08mol,2min内Z的平均速率v(Z)=Δn/Δt=![]() =4×103mol·(L·min)1,故A错误;
=4×103mol·(L·min)1,故A错误;
B.其他条件不变,降低温度,平衡向放热方向移动,正向移动,反应达到新平衡前:v(正)>v(逆),故B错误;
C.充入气体X和气体Y各0.16mol,平衡时Y的物质的的量为0.10mol,则改变量为0.06mol,此时Z的物质的量为0.12mol,浓度为0.012molL1,保持其他条件不变向容器中充入0.32mol气体X和0.32 mol气体Y,用建模思想,相当于两个容器,缩小容器加压,平衡不移动,浓度为原来2倍,即c(Z) = 0.024 mol·L1,故C错误;
D.平衡时,Y的物质的量为0.1mol,X的物质的量为0.1mol,Z的物质的量为0.12mol,该温度下此反应的平衡常数 ,故D正确;
,故D正确;
答案选D。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用于湿法电解制锌,如图为由锌灰制ZnSO4·7H2O晶体的工艺流程:
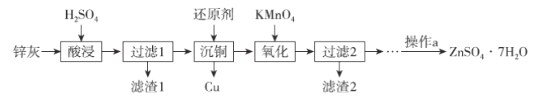
已知:①锌灰的主要成分为ZnO,还含有CuO、PbO、MnO和FeO;
②“滤渣2”的主要成分为Fe(OH)3和MnO(OH)2。
请回答下列问题:
(1)MnO(OH)2中Mn元素的化合价为_____________。
(2)“滤渣1”的主要成分为_____________。
(3)“氧化”时,需控制溶液的pH=5.1,Fe2+被氧化的离子方程式为_____________。
(4)操作a为_________、过滤、洗涤、干燥。
(5)ZnSO4·7H2O产品的纯度可用配位滴定法测定。准确称取一定量的ZnSO4·7H2O晶体加入250 mL的锥形瓶中,加水约20 mL,再加入2~3滴5%的二甲酚橙作指示剂、约5 mL六亚甲基四胺缓冲溶液,摇匀。用已标定的0.0160 mol/LEDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(ZnSO4·7H2O与EDTA按物质的量之比1:1反应)。实验数据如下表:
m(ZnSO4·7H2O)/g | 起始滴定管读数/mL | 终点滴定管读数/mL |
0.1692 | 0.20 | 26.50 |
ZnSO4·7H2O产品的纯度为_____________(保留2位有效数字)。
(6)工业上采用惰性电极作阳极电解ZnSO4溶液可实现湿法炼锌,电解过程中的离子方程式为___________。