题目内容
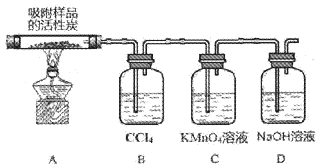
【题目】某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去)。

(1)配制氯化铁溶液时,需先把氯化铁晶体溶解在盐酸中,再加水稀释,这样操作的目的是___。
(2)通入足量SO2时,装置C中观察到的现象为_______________。
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式____________;
②检验有Fe2+生成的方法是____________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42 -,该做法不合理,理由是____________。
(4)D装置中倒置漏斗的作用是____________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有____________(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
【答案】抑制氯化铁水解 溶液由棕黄色变为浅绿色 2Fe3+ + SO2 +2H2O=SO42-+4H++2Fe2+ 取少量C中反应后的溶液于试管中,向其中滴入酸性高锰酸钾溶液,若褪色,说明有亚铁离子,不褪色说明没有亚铁离子 硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验 使气体充分吸收、防止溶液倒吸 b、c
【解析】
(1)氯化铁溶于水后,三价铁离子易水解,为抑制氯化铁水解, 需先把氯化铁晶体溶解在盐酸中,再加水稀释;
(2)通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁,则观察到溶液由棕黄色变为浅绿色;
(3)①二氧化硫与氯化铁的氧化还原反应,生成硫酸根离子、亚铁离子,离子反应为2Fe3+ + SO2 +2H2O=SO42-+4H++2Fe2+;
②二价铁离子具有还原性,可被高锰酸钾氧化,因此检验二价铁离子的方法为:取少量C中反应后的溶液于试管中,向其中滴入酸性高锰酸钾溶液,若褪色,说明有亚铁离子,不褪色说明没有亚铁离子;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性,则硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验,故做法不合理,
(4)二氧化硫为污染性气体,不能直接排放到空气中,需要进行尾气处理,因二氧化硫易溶于NaOH溶液,所以NaOH溶液吸收尾气,用倒置漏斗的作用为防止NaOH溶液倒吸;
(5)验证SO2具有还原性,可用高锰酸钾或碘水发生氧化还原反应,S元素的化合价升高,而SO2不能被浓硫酸、NaCl氧化, 因此,本题应选b、c.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】除去水蒸气后的水煤气主要含H2、CO、CO2及少量的H2S、CH4,继续除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气。
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) ![]() CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
① 此反应的化学平衡常数表达式为________;
② 下列能增大碳的转化率的措施是________ 。
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:CH4(g) +3/2O2(g) ![]() CO(g) + 2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO(g) + 2H2O(g) △H=-519kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是_______(填“X”或“Y”或“Z”),选择的理由是_______。
(3)合成气合成甲醇的主要反应是:2H2(g)+CO(g) ![]() CH3OH(g)△H=-90.8kJ·mol-1 T℃时,此反应的平衡常数为160,此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
CH3OH(g)△H=-90.8kJ·mol-1 T℃时,此反应的平衡常数为160,此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
① 该时间段内反应速率v(H2)=______ mol·L-1·min-1。
② 此时,正、逆反应速率的大小:v正______v逆(填“>”、“<”或“=”)
(4)生产过程中,合成气要进行循环,其目的是____________。
(5)甲醇可制成新型燃料电池,总反应为:2CH3OH+3O2 + 4KOH=2K2CO3+6H2O该电池负极的电极反应式为______。