题目内容
【题目】某学习小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)Na2O2的电子式为___________。它与水反应的离子方程式是__________________。
(2)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在;取少量溶液a,加入试剂___________(填化学式),有气体产生。
(3)乙同学查阅资料获悉:用KMnO4可以氧化H2O2并测定其含量。取20.00mL溶液,用稀H2SO4酸化,用0.002mol/L KMnO4溶液滴定,产生气体,溶液褪色,至终点时共消耗10.00mL KMnO4溶液。
①实验中,滴定时KMnO4溶液应装在__________(酸或碱)式滴定管中。
②用单线桥标出该反应电子转移的方向和数目:_______________。
2MnO4-+5H2O2+6H+ = 2Mn2++5O2↑+8H2O。
③溶液a中 c(H2O2)=___________ mol/L。
【答案】 ![]() 2Na2O2 + 2H2O = 4Na++4OH- + O2↑ MnO2(Cu2+、Fe3+也可) 酸
2Na2O2 + 2H2O = 4Na++4OH- + O2↑ MnO2(Cu2+、Fe3+也可) 酸 ![]() 0.0025
0.0025
【解析】试题分析:本题考查Na2O2与水反应的探究,氧化还原滴定实验,单线桥表示氧化还原反应。
(1)Na2O2的电子式为![]() 。Na2O2与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。
。Na2O2与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。
(2)要检验溶液a中存在H2O2,可向溶液中加入催化剂如MnO2(或Fe3+、Cu2+),若产生气体则证明含H2O2。
(3)①KMnO4溶液具有强氧化性,能腐蚀橡胶管,不能装在碱式滴定管中,KMnO4溶液应装在酸式滴定管中。
②在KMnO4溶液与H2O2的反应中,Mn元素的化合价由MnO4-中的+7价降至Mn2+中的+2价,H2O2中O元素的化合价由-1价升高到O2中的0价,用单线桥表示为![]() 。
。
③n(KMnO4)=0.002mol/L![]() 0.01L=2
0.01L=2![]() 10-5mol,根据关系式2KMnO4~5H2O2,n(H2O2)=
10-5mol,根据关系式2KMnO4~5H2O2,n(H2O2)=![]() n(KMnO4)=5
n(KMnO4)=5![]() 10-5mol,溶液a中c(H2O2)=5
10-5mol,溶液a中c(H2O2)=5![]() 10-5mol
10-5mol![]() 0.02L=0.0025mol/L。
0.02L=0.0025mol/L。

【题目】反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如下表所示:
,在不同的温度下该反应的平衡常数如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 如果在一定体积的密闭容器中加入CO2和H2各1mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
D. 某温度下,如果平衡浓度符合下列关系式: ![]() =
=![]() ,判断此时的温度是1000℃
,判断此时的温度是1000℃
【题目】我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
元素 | 元素性质或原子结构 |
A | 周期表中原子半径最小的元素 |
B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
C | 最外层p轨道半充满 |
D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
E | 位于ds区且原子的最外层电子数与A的相同 |
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1)B、C、D第一电离能由小到大为______________。
(2)E的二价离子的电子排布式为_____________。
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为_____________;1 mol A2B2D4分子中含有σ键数目为_____________。
(4)与化合物BD互为等电子体的阴离子化学式为___________ (任写一种)。
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是_______________。
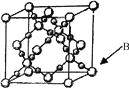
(6)BD2在高温高压下所形成晶体的晶胞如图所示。一个该晶胞中含___________个D原子。