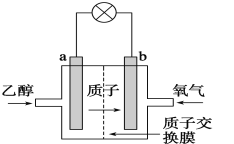
题目内容
【题目】某烃的衍生物W,仅含C、H、O三种元素.测其密度是相同条件下H2的45倍,各元素的质量百分含量如下表:
C% | H% | O% |
40.00% | 6.67% | 53.33% |
已知,W既能与乙酸反应,又能与乙醇反应,生成物都是酯和水。W的核磁共振氢谱图中有四种吸收峰,面积之比为3:1:1:1。
求:(1)W的相对分子质量为___;
(2)试计算确定W的分子式:___;
(3)W的结构简式为:___。
【答案】90 C3H6O3 CH3CH(OH)COOH
【解析】
⑴根据密度之比等于摩尔质量之比,等于相对密度,计算出有机物的相对分子质量。
⑵根据质量分数计算出碳、氢、氧的个数比,计算出最简比,再根据相对分子质量计算出分子式。
⑶W既能与乙酸反应,又能与乙醇反应,生成物都是酯和水,说明W含有—OH、—COOH,再根据核磁共振氢谱图中有四种吸收峰得出结构简式。
⑴有机物质的密度是相同条件下H2的45倍,所以有机物质的相对分子质量=45×2=90,故答案为:90。
⑵![]() ,所以设分子为(CH2O)n,结合相对分子质量为90,30n =90,得n=3,因此分子式为C3H6O3,故答案为:C3H6O3。
,所以设分子为(CH2O)n,结合相对分子质量为90,30n =90,得n=3,因此分子式为C3H6O3,故答案为:C3H6O3。
⑶W既能与乙酸反应,又能与乙醇反应,生成物都是酯和水,说明W的结构中有,—OH、—COOH,核磁共振氢谱图中有四种吸收峰,面积之比为3:1:1:1,得结构简式为CH3CH(OH)COOH;故答案为:CH3CH(OH)COOH。

练习册系列答案
相关题目